
分析 升高温度、增大反应物接触面积、增大反应物浓度、加入催化剂等都增大反应速率,但决定物质反应速率的是物质本身的性质,据此分析解答.
解答 解:夏天温度高,升高温度,增大活化分子百分数,导致反应速率增大,所以夏天的食品易发霉,冬天就不易发生该现象;
二氧化锰作双氧水分解反应的催化剂,增大活化分子百分数,导致反应速率加快;
同浓度、同体积的盐酸中放入同样大小的锌粒和镁条,镁条产生气体更快,因为Mg比Zn活泼,说明决定化学反应速率的是物质本身的性质,
故答案为:温度;催化剂;物质本身的性质.
点评 本题考查化学反应速率影响因素,为高频考点,明确温度、催化剂对化学反应速率影响原理是解本题关键,侧重考查学生分析判断能力,注意:外界因素只是影响因素,决定物质反应速率的是物质本身的性质.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,71gCl2和22.4LHCl | B. | 相同质量的氢气和氮气 | ||
| C. | 在0℃时,1体积的O2和1体积的HCl | D. | 相同体积的CO2和 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油中 | |
| B. | 试剂瓶中的液溴可用水封存,防止溴挥发 | |
| C. | 保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉 | |
| D. | 浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸 纯碱 孔雀石[Cu2(OH)2CO3] | B. | 硝酸 烧碱 硫酸钡 | ||
| C. | 醋酸 乙醇 碳酸钙 | D. | 盐酸 熟石灰 苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
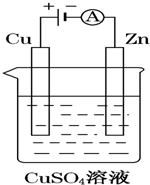 如图是一个电解过程示意图.
如图是一个电解过程示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com