
【题目】电镀是应用电解原理在某些金属表面镀上一薄层其它金属或合金的方法。在铁质铆钉上镀镍(Ni)能防止铁被腐蚀,如图1。实验室模拟铁片镀镍,装置如图2。

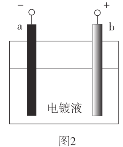
(1)b极材料是__。
(2)电镀液中含有NiSO4、NaCl和硼酸。
已知:NiSO4=Ni2++SO![]() 、Ni2++2H2ONi(OH)2+2H+
、Ni2++2H2ONi(OH)2+2H+
①a极的电极反应式是__。
②硼酸的作用是调节溶液的pH。pH较小时,a极易产生__气体,使镀层疏松多孔。pH较大时,a极会吸附__固体而使镀层含有杂质。
(3)铁质铆钉上镀镍能防止铁被腐蚀是因为镀层使铁与__等物质隔离。
【答案】镍(Ni) Ni2++2e-=Ni 氢气(H2) Ni(OH)2 O2和H2O
【解析】
电镀是应用电解原理,与电源正极相连的为电解池阳极,与电源负极相连的为电解池阴极,根据图示,a为电解池的阴极,b为电解池的阳极,在电镀过程中,待镀金属作阴极,镀层金属作阳极,则在铁片上镀镍时,铁是待镀金属,为电解池阴极,则a电极材料为Fe,发生的电极反应为Ni2++2e-= Ni;镍为镀层金属,为电解池阳极,b电极材料为Ni,发生的电极反应为Ni-2e-=Ni2+,据此分析解答。
(1)根据分析,b极材料是镍(Ni);
(2)①根据分析,a极的电极反应式是Ni2++2e-=Ni;
②由于镍离子在溶液中发生水解反应:Ni2++2H2ONi(OH)2+2H+,硼酸的作用是调节溶液的pH,阻止镍离子发生水解。若pH较小时,溶液中氢离子浓度增大,a极为阴极,电极上易发生反应:2H++2e-=H2↑,产生氢气(H2),使镀层疏松多孔;pH较大时,电解质溶液中由于镍离子水解生成Ni(OH)2,吸附在a极上而使镀层含有杂质;
(3)铁质铆钉上镀镍能防止铁被腐蚀是因为镀层使铁与O2和H2O等物质隔离,不易发生腐蚀。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】新型冠状病毒传染性和致病性比较强,佩戴口罩可以有效地预防新型冠状病毒感染。熔喷布是口罩的核心材料,主要是聚丙烯。下列说法正确的是( )
A.聚丙烯单体中最多7个原子共平面
B.聚丙烯能使酸性高锰酸钾溶液褪色
C.聚丙烯可以用(C3H6)n表示,是一种纯净物
D.橡胶、聚丙烯、纤维素都是天然的高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.![]() =1012的溶液中:Fe2+、Mg2+、NO
=1012的溶液中:Fe2+、Mg2+、NO![]() 、Cl-
、Cl-
B.澄清透明的溶液中:H+、Cu2+、SO![]() 、NO
、NO![]()
C.0.1mol/L的NaHCO3溶液中:Fe3+、K+、Cl-、SO![]()
D.由水电离产生的c(H+)=1×10-12mol/L的溶液中:K+、Al3+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
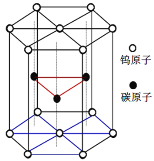
【题目】碳化钨(WC)是大型飞机发动机关键部位材料。
(1)基态钨原子的外围电子排布式为5d46s2,有___个未成对电子。
(2)在第二周期的非金属主族元素中,第一电离能由大到小顺序为___。
(3)硫氰化钾(KSCN)俗称玫瑰红酸钾,是铁离子的检验指示剂。
①SCN-中,中心原子碳的杂化类型是___,该离子的空间构型是___。
②SCN-的等电子体分子是___(任写一个)。
(4)C3H8和纯叠氮酸(HN3)的相对分子质量相近,但C3H8常温下是气态,而纯叠氮酸常温下是一种液体,沸点为308.8K,主要原因是___。
(5)NH3的键角是107°,NF3的键角是102.5°。NF3的键角比NH3的键角小,原因是___。
(6)碳化钨晶胞如图所示。①一个W原子与周围___个碳原子紧密相邻且等距。WC的熔点为2870℃,沸点是3000℃,硬度非常大,它的晶体类型是___。
②已知该晶胞边长为acm,高为hcm,NA为阿伏伽德罗常数。WC的摩尔质量为Mg·mol-1。该晶体密度为___g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铁钉在不同溶液中的腐蚀情况。实验装置与数据如下:
实验装置 | 实验数据 |
|
|
下列说法不正确的是
A.①的负极反应:Fe-3e-=Fe3+
B.③的正极反应:O2+2H2O+4e-=4OH-
C.②可能同时发生析氢腐蚀和吸氧腐蚀
D.金属的电化学腐蚀以哪种类型为主与溶液的pH有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能准确表达其变化的是
A.钠在空气中变暗:2Na+O2 =Na2O2
B.蔗糖加浓硫酸变黑:C12H22O11![]() 12C+11H2O
12C+11H2O
C.漂白粉久置失效:Ca(ClO)2+CO2+H2O=CaCO3+ 2HC1O 2HC1O=2HCl+O2
D.SO2形成酸雨:2SO2+O2+2H2O=2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体锌二次电池具有电压高、成本低、安全性强和可循环使用等特点。已知:①Zn(OH)2+2OH-=Zn(OH)![]() ;②KOH凝胶中允许离子存在、生成或迁移。下列说法错误的是
;②KOH凝胶中允许离子存在、生成或迁移。下列说法错误的是
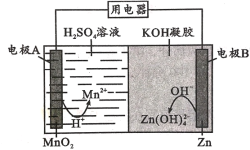
A.电池放电时,电子由电极B经导线流向电极A
B.电池反应为MnO2+ Zn + 4H++4OH-=Mn2+ + Zn(OH)![]() +2 H2 O
+2 H2 O
C.电池充电时,H+向电极A移动
D.电池充电时,电极B的质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是玻璃、制皂、造纸、纺织和漂染等工业的基本原料。
Ⅰ.世界最早工业生成纯碱的方法是路布兰(N.Leblanc)法,其流程如图:

(1)流程Ⅰ的反应是___反应(填“氧化还原”或“非氧化还原"),流程Ⅱ的反应是分步进行的,a.Na2SO4(s)与过量木炭反应生成Na2S(s);b.Na2S(s)与石灰石发生复分解反应生成Na2CO3,a步的反应化学方程式为___。
Ⅱ.19世纪60年代后生产纯碱的路布兰法被索尔维(E.Solvay)氨碱法所取代,其生产流程如图:
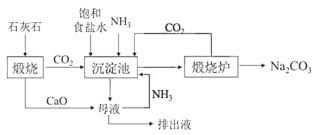
(2)氨碱法中加入NH3的主要作用是___。
(3)与路布兰法相比,氨碱法的优点有___。(写出一条即可)
Ⅲ.1939年候德榜首先提出并自行设计了联合制碱法——利用合成氨工业上的NH3和CO2和NaCl为原料生产纯碱。
(4)侯德榜制碱法的关键还在于对从反应后的混合物中分离出NaHCO3后所得溶液的处理:在溶液中加入NaCl固体并通入NH3,并在___(填温度范围)下析出NH4Cl。
表1不同温度下NaCl和NH4Cl的溶解度数据(g/100g水)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是
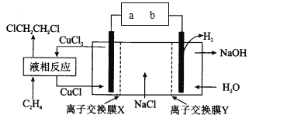
A.a为电源的负极
B.CuCl2能将C2H4还原为 l , 2-二氯乙烷
C.X、Y依次为阳离子交换膜、阴离子交换膜
D.该装置总反应为CH2=CH2+ 2H2O + 2NaCl![]() H2+ 2NaOH + ClCH2CH2Cl
H2+ 2NaOH + ClCH2CH2Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com