
| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
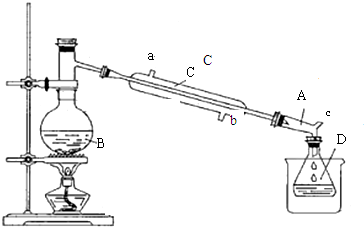
分析 (1)在蒸馏烧瓶中加入碎瓷片,可以防止瀑沸;
(2)根据仪器B的构造进行解答;
(3)冷凝管的通水方向为逆向通水,据此进行解答;
(4)根据溴乙烷沸点较低,难溶于水进行分析;
(5)乙醇沸点较低,生成的溴乙烷中会混有杂质乙醇,加水的目的是除去杂质乙醇;
(6)根据乙醇的体积计算出理论上生成溴乙烷的物质的量,然后根据实际产生的溴乙烷的量计算出产率.
解答 解:(1)在蒸馏烧瓶中加入碎瓷片,可以防止瀑沸,故答案为:防止瀑沸;
(2)根据图示装置可知,仪器B为蒸馏烧瓶,故答案为:蒸馏烧瓶;
(3)为了提高冷凝效果,冷凝管中通水方向采用逆向通水的方法,即从b进水,从a出水,故答案为:b;
(4)根据表中数据可知,溴乙烷的沸点为38.4℃,且难溶于水,所以使用冰水冷却溴乙烷,故答案为:冷却溴乙烷;
(5)制取的溴乙烷中会混有乙醇,根据溴乙烷难溶于水,而乙醇易溶于水,可以加水振荡后除去溴乙烷中溶解的乙醇,故答案为:除去溶解在溴乙烷中乙醇;
(6)50mL乙醇的质量为:0.79g/mL×50mL=39.5g,乙醇的物质的量为:$\frac{39.5g}{46g/mol}$≈0.86mol,根据反应原理可知,理论上生成溴乙烷的物质的量为0.86mol;
52mL溴乙烷的物质的量为:$\frac{1.42g/mL×52mL}{109g/mol}$≈0.68mol,溴乙烷的产率为:$\frac{0.68mol}{0.86mol}$×100%≈79%,
故答案为:79%.
点评 本题考查了溴乙烷的制取方法,题目难度中等,涉及了仪器构造及使用方法、物质的提纯与除杂、化学计算等知识考查,注意掌握溴乙烷的制取原理,(6)为易错点,注意溴乙烷产率的计算方法.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,E的电子式
,E的电子式 ,y的结构式H-Cl;
,y的结构式H-Cl; ;反应②的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应⑤的离子方程式为2Fe3++Fe=3Fe2+
;反应②的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应⑤的离子方程式为2Fe3++Fe=3Fe2+查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液与澄清石灰水的反应 | |
| B. | 氢氧化铜与稀硫酸的反应 | |
| C. | 锌与氯化铜溶液的反应 | |
| D. | 二氧化碳与生石灰作用生成碳酸钙的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
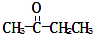 )、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.
)、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 50% | C. | 75% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 | |
| B. | 向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀:再加入少许浓硫酸,迅速搅拌,探究浓硫酸的吸水性 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com