
| A. | 该温度下,氯化钠的溶解度S=$\frac{w}{1-w}$g | |
| B. | 溶液中溶质的物质的量浓度c(NaCl)=$\frac{m}{58.5V}$mol/L | |
| C. | 溶液中溶质物质的量浓度c(NaCI)=$\frac{10ρw}{58.5}$mol/L | |
| D. | 溶液中溶质的质量分数w=$\frac{58.5c}{10ρ}$% |
分析 根据n=$\frac{m}{M}$、c=$\frac{n}{V}$、c=$\frac{1000ρω}{M}$计算出氯化钠溶液的物质的量浓度;根据溶解度=$\frac{溶质质量}{溶剂质量}$×100g计算出该温度下NaCl的溶解度,根据$\frac{溶质质量}{溶液质量}$×100%计算溶质的质量分数,以此计算解答.
解答 解:A.该氯化钠溶液的质量分数为w%,则100g溶液中溶质的质量为w克,溶剂的质量为(100-w)g,该温度下氯化钠的溶解度为:S(NaCl)=$\frac{w}{100-w}$×100g=$\frac{100w}{100-w}$g,故A错误;
B.溶液中所含NaCl的质量为m g.溶质的物质的量为$\frac{m}{58.5}$mol,溶液体积为V×10-3L,则溶液中溶质的物质的量浓度c(NaCl)=$\frac{m}{58.5V}$×1000 mol•L-1,故B正确;
C.由c=$\frac{1000ρω}{M}$可知,溶液中溶质的物质的量浓度c(NaCl)=$\frac{1000ρw}{58.5}$mol•L-1,故C错误;
D.溶液中所含NaCl的质量为m g,溶液质量为ρVg,质量分数为$\frac{m}{ρV}$×100%,或由c=$\frac{1000ρω}{M}$可知质量分数w=$\frac{58.5c}{1000ρ}$,故D错误;
故选B.
点评 本题考查物质的量浓度的有关计算,为高频考点,题目难度中等,把握物质的量为中心的基本计算及相关计算公式为解答的关键,侧重分析、理解能力及化学计算能力的考查.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | 向水中通氯气:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 在强碱溶液中,次氯酸钠与Fe(OH)3 反应生成Na2FeO4,离子方程式:3ClO-+2Fe(OH)3═2FeO42-+H2O+3Cl-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.23~2.23 | B. | 2.23~3.19 | C. | 3.19~5.19 | D. | 4.19~6.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何反应都伴有能量的变化 | |
| B. | 化学反应中的能量变化可表现为热量的变化 | |
| C. | 反应物的总能量高于生成物的总能量时,发生吸热反应 | |
| D. | 反应物的总能量低于生成物的总能量时,发生吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
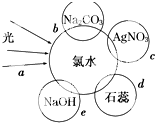 氯气是一种重要的化工原料.
氯气是一种重要的化工原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com