
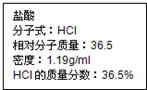
 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:分析 (1)依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
(2)盐酸溶液中,溶液浓度、溶液密度都与溶液体积大小无关,而氯化氢的物质的量、氯离子数目与溶液体积大小有关;
(3)①依据容量瓶构造解答;
②依据配制一定物质的量浓度溶液一般步骤排序;
B.依据溶液稀释过程中所含溶质的物质的量保持不变计算需要浓盐酸体积;
C.依据配制溶液体积和容量瓶规格选择合适的容量瓶;
E.F.依据定容的正确操作解答;
解答 解:(1)密度为1.19g/mL,质量分数为36.5%的盐酸物质的量浓度C=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L;
故答案为:11.9;
(2)A.溶液中HCl的物质的量大小取决于溶液体积大小和溶液浓度,故A错误;
B.溶液具有均一性,溶液的浓度与溶液体积大小无关,故B正确;
C.溶液中Cl-的数目与溶液浓度、溶液体积大小及溶质化学式组成有关,故C错误;
D.溶液具有均一性,溶液的密度与溶液体积大小无关,故D正确;
故答案为:BD;
(3)①容量瓶上需标有温度、容量、刻度线;
故答案为:ACE;
②配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定、摇匀、装瓶等,所以正确的操作顺序为:BCAFED;
故答案为:BCAFED;
B.配制480mL物质的量浓度为0.400mol•L-1的稀盐酸需要使用500mL容量瓶,设需要浓盐酸体积为V,则依据溶液稀释过程中所含溶质的物质的量保持不变得:V×11.9mol/L=0.400mol/L×500mL,解得V=16.8mL;
故答案为:16.8;
C.配制480mL物质的量浓度为0.400mol•L-1的稀盐酸需要使用500mL容量瓶;
故答案为:500mL容量瓶;
E.F.洗涤后,继续向容量瓶中加入蒸馏水到离刻度线1-2cm改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
故答案为:E.胶头滴管;
F.1~2cm;
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度中等,明确配制步骤为解答关键,题目难度不大.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 钾离子结构示意图: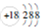 | |
| B. | N2H4的电子式: | |
| C. | 聚丙烯的结构简式: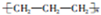 | |
| D. | 中子数为79、质子数为55的铯(Cs)原子:${\;}_{55}^{79}$Cs |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
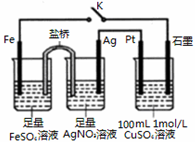
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 闭合K,石墨电极上只生成铜 | |
| C. | 当有0.1mol Fe溶解时,流经电解液的电子个数为1.204×1023 | |
| D. | 导线中流过0.3mol电子时,加入11.1gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
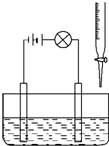 在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):
在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用品: 有效成分:NaCl用途:做调味品 有效成分:NaCl用途:做调味品 | |
| B. | 用品: 有效成分:Na2CO3用途:做发酵粉 有效成分:Na2CO3用途:做发酵粉 | |
| C. | 用品: 有效成分:Al(OH)3用途:做抗酸药 有效成分:Al(OH)3用途:做抗酸药 | |
| D. | 用品: 有效成分:Ca(ClO)2用途:做消毒剂 有效成分:Ca(ClO)2用途:做消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子 | |
| C. | 常温常压下,46g NO2、N2O4混合物中,分子数为NA | |
| D. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、Cl-、SO42- | B. | K+、CO32-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com