
 我国自行设计和生产的电动燃料汽车,该车装有“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.则下列叙述正确的( )
我国自行设计和生产的电动燃料汽车,该车装有“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.则下列叙述正确的( )| A. | 通入O2的电极发生氧化反应 | |
| B. | 通入H2的电极是正极 | |
| C. | 正极的电极反应为O2+4H++4e-═2H2O | |
| D. | 总反应的化学方程式为:O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
分析 在燃料电池中,通入燃料的电极是负极,该极上发生失电子的氧化反应,通入氧气的电极是正极,该极上发生得电子的还原反应,总反应即为燃料燃烧的化学方程式.
解答 解:A、根据燃料电池的电极反应规律:通入O2的电极是正极,发生还原反应,故A错误;
B、根据燃料电池的电极反应规律:通入燃料氢气的电极是负极,故B错误;
C、通入氧气的电极是正极,该极上发生得电子的还原反应,在酸性环境下,电极反应为:O2+4H++4e-═2H2O,故C正确;
D、在燃料电池中,根据燃料电池的电极反应规律:总反应即为燃料燃烧的化学方程式,即O2+2H2═2H2O,不需要点燃条件,故D错误.
故选C.
点评 本题考查学生燃料电池的工作原理知识,可以根据所学知识进行回答,难度不大.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| B. | 根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等 | |
| C. | 镁铝合金、漂白粉、水玻璃、王水均为混合物 | |
| D. | 纯碱、熟石灰、醋酸、食盐水均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| C. | 过氧化钠固体与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向氢氧化钠溶液中通入足量的CO2气体:CO2+2OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
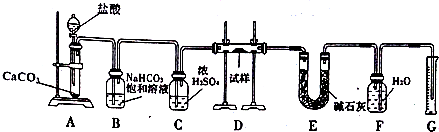
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 要提纯的物质 (杂质) | 溴乙烷 (乙醇) | 乙醇 (水) | 乙醇 (乙酸) | 溴苯 (溴) |
| (1)选用试剂 | ||||
| (2)分离方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
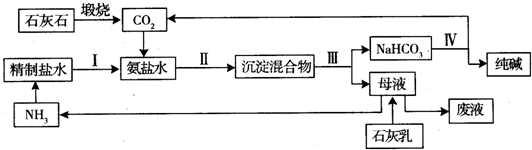
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com