
| A. | NaOH | B. | KSCN | C. | KMnO4 | D. | 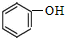 |
科目:高中化学 来源: 题型:选择题
| A. | CuCl2(CuO) | B. | NaOH(NaOH) | C. | CuSO4(CuO) | D. | NaCl(盐酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑨ | B. | ①②③④ | C. | ⑥⑦⑧⑨ | D. | ③④⑤⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表而镀铜可以增强其抗腐蚀性 | |
| B. | 用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+$\frac{y}{4}$)O2$→_{高温}^{催化剂}$xCO2+$\frac{y}{2}$H2O | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 废旧电池中含有的重金属离子对水和土壤会造成污染,因而不能随意丢弃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 标准状况下,4.0 g CH4中含有共价键的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砖块中的主要成分是硅酸盐 | |
| B. | 青砖中的铁元素主要以氢氧化亚铁的形式存在 | |
| C. | 红砖中的铁元素主要以氧化铁的形式存在 | |
| D. | 青砖中的铁元素主要以氧化亚铁的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| B. | 淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物 | |
| C. | 在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解 | |
| D. | 北京奥运吉祥物“福娃”的材质是PVC(聚氯乙烯),其单体的结构是CH2=CHCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
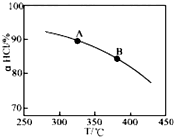 用O2将HCl转化为Cl2,可提高效益,减少污染,
用O2将HCl转化为Cl2,可提高效益,减少污染,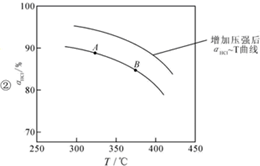 增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.
增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com