
【题目】某固体混合物X,含有![]() 、
、![]() 、
、![]() 和
和![]() 中的几种,进行如下实验:
中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与![]() 溶液作用,无变化。
溶液作用,无变化。
下列说法不正确的是( )
A.混合物X中必定含有![]() ,不含
,不含![]()
B.溶液Z中溶质主要是钠盐,且必含![]()
C.灼烧沉淀Y,可能得到黑色物质
D.往溶液Z中加入Cu粉,若不溶解,说明X中不含![]()
【答案】D
【解析】
某固体混合物X,含有![]() 、
、![]() 、
、![]() 和
和![]() 中的几种,进行如下实验:
中的几种,进行如下实验:
①X与水作用有气泡冒出,四种物质中能生成气体的只有![]() ,所以一定有
,所以一定有![]() ,而几种物质中没有酸,可知推测因为发生双水解生成了二氧化碳,能与
,而几种物质中没有酸,可知推测因为发生双水解生成了二氧化碳,能与![]() 在溶液中双水解的有
在溶液中双水解的有![]() 、
、![]() 和
和![]() ;得到有色沉淀Y,则Fe(OH)3、Cu(OH)2中至少有一种Al(OH)3不确定;弱碱性溶液Z,说明溶液中不存在铝离子、铁离子和铜离子;
;得到有色沉淀Y,则Fe(OH)3、Cu(OH)2中至少有一种Al(OH)3不确定;弱碱性溶液Z,说明溶液中不存在铝离子、铁离子和铜离子;
②沉淀Y与![]() 溶液作用,无变化说沉淀中没有Al(OH)3,则X中一定没有
溶液作用,无变化说沉淀中没有Al(OH)3,则X中一定没有![]() ,据此再结合选项分析。
,据此再结合选项分析。
A. 根据分析可知混合物X中必定含有![]() ,不含
,不含![]() ,故A正确;
,故A正确;
B.溶液Z显弱碱性,所以大量存在的阳离子只能是钠离子,碳酸钠的水解分两步:CO32-+H2O=HCO3-+OH-;HCO3-+ H2O =H2CO3+OH-;由于发生双水解反应产生了二氧化碳且溶液显碱性说明溶液中依然存在第二步水解,第一步水解有可能存在,即溶液中一定有碳酸氢根,所以溶液Z中溶质主要是钠盐,且必含![]() ,故B正确;
,故B正确;
C.沉淀Y中可能含有氢氧化铜,故灼烧可以得到黑色固体,故C正确;
D.溶液Z显弱碱性,一定不存在![]() ,故D错误;
,故D错误;
故答案为D。


科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产生活中有广泛的应用。
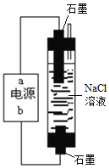
(1)一种环保型家用“84”消毒液的发生装置如右图,电源的b极为________极,电解制取NaClO的离子反应方程式为_______。
(2)用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g) ![]() COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
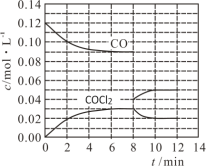
在0~6 min内υ(Cl2)=____________________,第8 min时改变的条件是________________。在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将________(填“增大”“不变”或“减小”)。
(3)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气——氯水体系中存在以下平衡关系:
![]() Cl2(g)
Cl2(g) ![]()
![]() Cl2(aq) K1=10-0.6
Cl2(aq) K1=10-0.6
Cl2(aq) + H2O![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO ![]() H+ + ClO- Ka
H+ + ClO- Ka
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
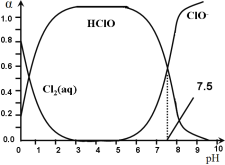
则①Ka = __________;
②Cl2(g) + H2O ![]() HClO + H+ +Cl- K = __________;
HClO + H+ +Cl- K = __________;
③用氯处理饮用水时,pH=6.5时杀菌效果比pH=7.5时___(填“好”、“差”或“相同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
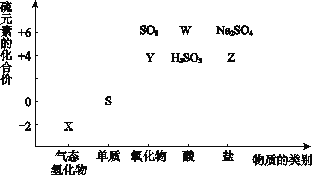
(1)Y的化学式为_________,检验Y所用的试剂是________________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是
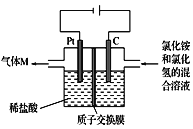
A.每生成1 mol NCl3,理论上有4 mol H+经质子交换膜从右侧向左侧迁移
B.石墨极的电极反应式为NH4++3Cl--6e-==NCl3+4H+
C.可用湿润的淀粉-KI试纸检验气体M
D.电解过程中,质子交换膜右侧溶液的pH会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验事实得出的结论正确的是
实验事实 | 结论 | |
A | 某物质在熔融态下能导电 | 该物质一定是电解质 |
B | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
C | SO2的水溶液能导电 | SO2为电解质 |
D | 已知:Cl2+2FeCl2=2FeCl3反应能发生 | 氧化性:Cl2>FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素X、Y、Z、W的原子序数依次增加,且均不大于20,X的单质是手机电池重要的电极材料;常温下,Y的两种气态氧化物之间可发生可逆反应;X、Y、W最外层电子数之和与Z的最外层电子数相等;W能形成多种氧化物。下列说法正确的是
A.常温下,Z的单质与Y的简单氢化物相遇,可能产生白烟
B.Z非金属性强于Y,其对应含氧酸的酸性:Z>Y
C.原子半径:X>Y;简单离子半径:Z<W
D.X、W的单质均为活泼金属,通常保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是
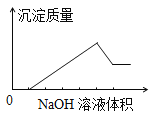
A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青菜含有维生素C和植物纤维有助于清除人体吸入的粉尘颗粒。已知维生素C的结构如图所示,有关判断不正确的是

A. 维生素C中含有3种官能团
B. 维生素C分子式为C6H8O6
C. 维生素C能使酸性高锰酸钾溶液褪色
D. 维生素C在碱性溶液中能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。采用软锰矿(主要成分为MnO2)可制备高纯MnO2,其流程如下:

下列叙述错误的是
A. “含Mn2+、A13+的溶液”中还含Fe3+
B. 加入“氨水”同时搅拌,搅拌的目的是提高反应速率
C. “滤渣”可完全溶解在NaOH溶液中
D. 电解含Mn2+的溶液,MnO2为阳极产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com