
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
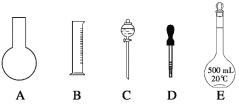
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 ____________________。
(2)在容量瓶的使用方法中,下列操作不正确的是____________。
A.使用容量瓶前检验是否漏水。
B.容量瓶用水洗净后,再用待配溶液洗涤。
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为_______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为________mL。
【答案】AC 烧杯、玻璃棒 BCD 2.0 小于 13.6
【解析】
(1). 配制一定物质的量浓度的上述溶液需要的仪器有:量筒、托盘天平、烧杯、玻璃棒、胶头滴管、容量瓶等,则肯定不需要的是圆底烧瓶和分液漏斗,还需要的玻璃仪器是烧杯和玻璃棒,故答案为:AC;烧杯、玻璃棒;
(2). A. 容量瓶有瓶塞,配制过程中需要反复颠倒摇匀,为了避免漏液,使用容量瓶前要检验是否漏水,故A正确;
B. 容量瓶用水洗净后,再用待配溶液洗涤,会导致配制的溶液中溶质的物质的量偏大,配制的溶液浓度偏高,故B错误;
C. 容量瓶为定量仪器,只能用于配制一定物质的量浓度的溶液,不能用于溶解或者稀释溶质,故C错误;
D. 容量瓶为定量仪器,只能用于配制一定物质的量浓度的溶液,不能用于溶解或者稀释溶质,故D错误;
E. 定容结束后,需要进行摇匀,操作方法为:盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确,答案为:BCD;
(3). 配制NaOH溶液时需用托盘天平称量NaOH固体的质量,实验室无450mL规格的容量瓶,需选用500mL规格的容量瓶进行配制,配制氢氧化钠溶液时需要NaOH的物质的量为:0.1mol/L×0.5L=0.05mol,需要氢氧化钠的质量为:40g/mol×0.05mol=2.0g;在实验中其他操作均正确,若定容时仰视刻度线,会导致加入的蒸馏水体积超过容量瓶刻度线,配制的溶液体积偏大,浓度偏小,即小于0.1mol/L,故答案为:2.0;小于;
(4). 用量筒量取浓硫酸溶液的体积,质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为c(H2SO4)=![]() =18.4mol/L,设需用量筒量取浓硫酸的体积为a mL,则a×10-3L×18.4mol/L=0.5L×0.5mol/L,解得a=13.6mL,故答案为:13.6。
=18.4mol/L,设需用量筒量取浓硫酸的体积为a mL,则a×10-3L×18.4mol/L=0.5L×0.5mol/L,解得a=13.6mL,故答案为:13.6。


科目:高中化学 来源: 题型:
【题目】为模拟海水制备 MgO,某同学设计并完成了如下实验:
模拟海水中离子c(mol/L) | Na+ | Mg2+ | Ca2+ | Cl― | HCO3 |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
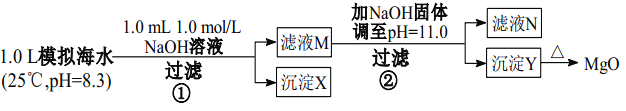
下列说法正确的是
A. 模拟海水呈碱性,可说明 HCO3-的电离能力大于水解能力
B. 沉淀物 X 为 CaCO3,沉淀物 Y 为 Mg(OH)2
C. MgCO3的溶解度比 Mg(OH)2 的小
D. 滤液 M 中存在 Mg2+,不存在 Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在___________对自旋相反的电子。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为__________________________。
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
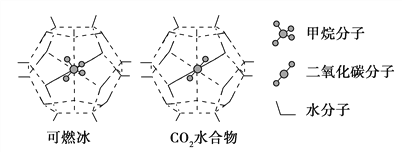
①下列关于CH4和CO2的说法正确的是________(填序号)。
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表所提供的数据分析,提出该设想的依据是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为____________________________,其第一电离能比Be ____________(填“大”或“小”)
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______________。
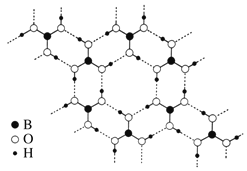
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。
①B原子的杂化方式为_____________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:________________________________________________________。
② 路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸的原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将10 mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
A.CO、H2S的转化率之比为1:1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1 mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、甲醇既是重要的化工原料,又可作为燃料,利用CO和H2在催化剂作用下可合成甲醇(g)。
(1)已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
合成甲醇(g)的热化学方程式为______________________________________________。
(2)500K、101KPa条件下,反应过程中测得n(CO)、n(H2)、n(CH3OH)随时间t变化的关系如图甲所示。现保持其它条件不变,起始只改变温度,在改变的这个温度下反应至t1时刻,此时n(H2)比图象中的值大,那么该温度可能是________。
A、700K B、373K C、以上均不对
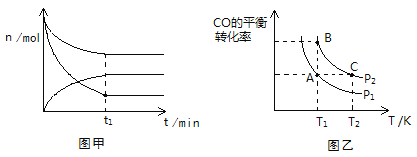
(3)在一容积可变的密闭容器中充入1 mol CO和2 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)和压强(P)的变化曲线如图乙所示。P1、P2的大小关系为________;A、B、C三点的平衡常数(K)大小关系为______________________。
Ⅱ、可逆反应:①X(g)+2Y(g)![]() 2Z(g);②2M(g)
2Z(g);②2M(g)![]() N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
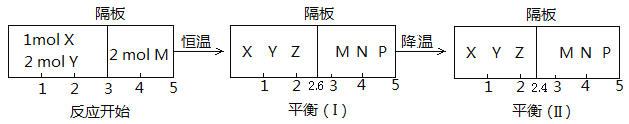
(4)反应①的正反应ΔH______0(填“>”或“<”)。
(5)反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为_________(用分数表示)。
(6)在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数(Ⅰ)______(Ⅱ)。
A、大于 B、小于 C、等于 D、无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是
A. 此配合物中存在离子键、配位键、极性键、非极性键
B. 配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6,配位原子有C和N
C. 1mol配合物中σ键数目为12NA
D. 该配合物为离子化合物,易电离,1mol配合物电离共得到3NA阴阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com