
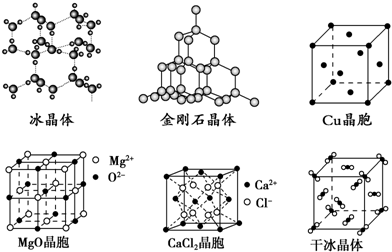
分析 (1)原子晶体中原子间以共价键结合;
(2)熔点的一般规律:原子晶体>离子晶体>分子晶体,同种晶体根据微粒间的作用力大小比较;
(3)离子半径越小,离子带电荷越多,晶格能越大;
(4)Cu原子占据面心和顶点,根据均摊法计算;根据图可知,每个Ca2+周围有8个Cl-,而每个Cl-周围有4个Ca2+;
(5)分子间含有氢键时,其熔沸点较高.
解答 解:(1)原子晶体中原子间以共价键结合,则粒子之间以共价键结合形成的晶体是金刚石晶体;
故答案为:金刚石晶体;
(2)熔点的一般规律:原子晶体>离子晶体>分子晶体,冰和干冰属于分子晶体,熔点:冰>干冰,MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2,金刚石是原子晶体,则熔点由高到低的顺序为:金刚石、MgO、CaCl2、冰、干冰;
故答案为:金刚石、MgO、CaCl2、冰、干冰;
(3)因为MgO中离子带两个电荷,NaCl中离子带一个电荷,氧离子半径小于氯离子,根据离子半径越小,离子带电荷越多,晶格能越大,可得MgO晶体的晶格能大于NaCl晶体的晶格能,
故答案为:MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数,且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-);
(4)Cu原子占据面心和顶点,则每个Cu晶胞中实际占有的原子数为$\frac{1}{8}$×8+$\frac{1}{2}$×6=4;根据氯化钙的晶胞图可知,每个Ca2+周围有8个Cl-,而每个Cl-周围有4个Ca2+,所以
CaCl2晶体中Ca2+的配位数为8;
故答案为:4;8;
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,水分子间含有氢键,氢键的作用力大于范德华力,所以其熔沸点较高;
故答案为:H2O分子之间能形成氢键.
点评 本题考查物质结构与性质,涉及晶体的熔点比较、晶胞结构、晶格能、均摊法在晶胞计算中的应用、氢键等,题目难度中等,解题时要注意基础知识的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将LiCoO2改写成为氧化物的形式为Li2O•Co2O3 | |
| B. | 该电池的电解液必须使用有机溶剂主要是由于有机溶剂有良好的导电性 | |
| C. | Li是3号元素,是最轻的金属之一,这类电池质能比高 | |
| D. | 在电池充放电时,Li+在两个电极之间往返嵌入和脱嵌.该电池的充放电反应方程式为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
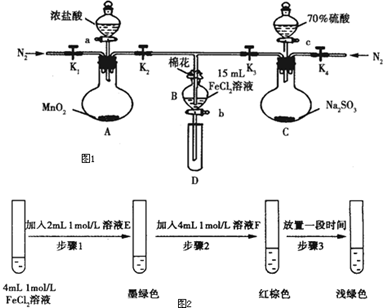
| 过程Ⅳ:B溶液中含有的离子 | 过程Ⅵ:B溶液中含有的离子 | |
| 甲 | 有Fe3+,无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
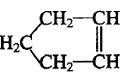 可简写为
可简写为 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: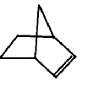
| A. | 易溶于水 | B. | 能发生氧化反应 | C. | 能发生加成反应 | D. | 能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||||||||||||
| W | T | M | F | ||||||||||||||
| B | D | Z | J | L | H | V | |||||||||||
| C | E | G | Q | ||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
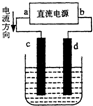
| A. | a为负极、b为正极 | B. | c电极上发生还原反应 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com