
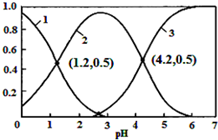
 已知H2SO3?HSO3-+H+,Ka1;HSO3-?SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
已知H2SO3?HSO3-+H+,Ka1;HSO3-?SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )| A. | pH=1.2溶液中:c(Na+)+c(H+)═c(OH-)+c(H2SO3) | |
| B. | 常温下,$\frac{{c}^{2}(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})•c(S{{O}_{3}}^{2-})}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度先增大后减小 | |
| D. | 曲线3表示的微粒是SO32- |
分析 A、pH=1.2时,溶液中存在HSO3-,根据此时的电荷守恒判断;
B.常温下$\frac{c(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})c(S{{O}_{3}}^{2-})}$=$\frac{c(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})c(S{{O}_{3}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{K{a}_{1}}{K{a}_{2}}$;
C.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中,酸性减弱,水的电离被抑制程度减小;
D.根据图象可知,溶液pH越大,3表示的离子的物质的量分数逐渐增大,据此判断曲线3表示的离子;
解答 解:A、溶液pH=1.2时,此时溶液中的亚硫酸根离子的浓度为0,H2SO3、HSO3-的含量相同浓度相同,而根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),所以c(Na+)+c(H+)═c(OH-)+c(H2SO3),故A正确;
B.坐标(1.2,0.5)时H2SO3、HSO3-的含量相同,则Ka1=c(H+)=10-1.2,坐标(4.2,0.5)时HSO3-和SO32-的浓度相等,Ka2=c(H+)=10-4.2,常温下$\frac{c(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})c(S{{O}_{3}}^{2-})}$=$\frac{c(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})c(S{{O}_{3}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{1{0}^{-1.2}}{1{0}^{-4.2}}$=1000,故B正确;
C.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中,酸性减弱,水的电离被抑制程度减小,水的电离度先增大,故C错误;
D.由图象可知,溶液pH越大,3表示的离子的物质的量分数逐渐增大,则曲线3表示的是SO32-,故D正确;
故选C.
点评 题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较,题目难度中等,明确曲线变化对应离子为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | NH3极易溶于水,可用于工业制冷剂 | |
| B. | 木炭具有还原性,可用于冰箱和居室除臭剂 | |
| C. | Al2O3是两性氧化物,可用于制造高温材料 | |
| D. | Na、K合金熔点低且导热,可用于快中子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验序号 | 反应温度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/(mol•L-1) | V/ml | c/(mol•L-1) | V/ml | ||
| A | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 5 | 0.1 | 5 | 0.1 | 10 |
| 预测 | 实验操作 | 实验现象 | ?现象解释 | |
| 探究① | Na2S2O3溶液呈碱性 | 溶液pH=8 | S2O32-+H2O HS2O3-+OH- | |
| 探究② | Na2S2O3有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 氯水颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
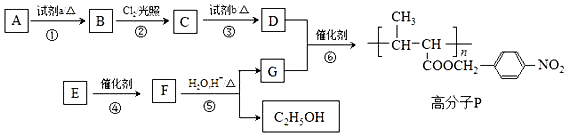
 +HO-NO2$→_{△}^{浓H_{2}SO_{4}}$
+HO-NO2$→_{△}^{浓H_{2}SO_{4}}$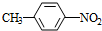 +H2O.
+H2O.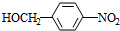 +
+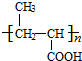 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +nH2O.
+nH2O.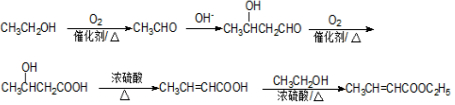 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com