
A、中子数为18的氯原子结构示意图: | ||
B、质量数为37的氯原子:
| ||
C、Cl-的结构示意图: | ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- |
 ,故A错误;
,故A错误;37 17 |
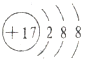 ,故C正确;
,故C正确;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、SO2为0.6 mol/L,O2为0.3mol/L |
| B、SO2为0.4mol/L |
| C、SO3为0.6 mol/L |
| D、SO2、SO3均为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B、目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 |
| C、2005年10月12日发射成功的“神舟六号”载人飞船使用了大量的复合材料 |
| D、合成高分子材料的广泛应用是有百利而无一害 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 标准液(ml) | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
| 吸收液(ml) | 10.00 | 9.80 | 9.60 | 9.40 | 9.20 | 9.00 |
| 二氧化硫含量(μg) | 0 | 5.00 | 10.00 | 15.00 | 20.00 | 25.00 |
| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 吸光度 | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com