
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+ B(g)![]() xC(g)+2D(g),经5min后达到平衡,测得D的浓度为0.5mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1mol/(L·min)
xC(g)+2D(g),经5min后达到平衡,测得D的浓度为0.5mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1mol/(L·min)
请计算:(写出计算过程,无过程不给分)
(1)平衡时A的浓度;______反应开始前容器中B的物质的量;_____
(2)前5 min内用B表示的平均反应速率;______
(3)化学反应方程式中x的值;_____
(4)5min时物质A的转化率。____
【答案】0.75 3 0.05 2 50%
【解析】
(1)先根据D的浓度求出D的物质的量,再由方程式求出A、B的物质的量;
(2)先求出反应的B的物质的量,再根据平均反应速率公式计算B的平均反应速率;
(3)根据同一反应中反应速率之比等于化学计量数之比求出x值;
(4)5min时物质A的转化率为=A的变化量/A的起始量×100%.
(1)5分钟后,n(D)=CV=0.5mol·L-1×2L=1mol,设反应开始前放入容器中A、B物质的量为mmol,
3A(g)+B(g)![]() xC(g)+2D(g),
xC(g)+2D(g),
n前/mol m m 0 0
n后/mol( m-1.5)( m-0.5) 1
c(A):c(B)=3:5=( m-1.5):( m-0.5)
m=3 mol
此时A的浓度c(A)=(3-1.5)mol/2L=0.75mol·L-1;
(2)设反应的B的物质的量为nmol,
3A(g)+B(g)![]() xC(g)+2D(g),
xC(g)+2D(g),
1 2
nmol 1mol
n=0.5
根据v(B)=![]() =0.05 mol/(L.min)
=0.05 mol/(L.min)
(3)根据同一反应中反应速率之比等于化学计量数之比,所以v(B):v(C)=0.05 mol/(L·min):0.1mol/(L·min)=1:x,所以x=2;
(4)5min时物质A的转化率为=A的变化量/A的起始量×100%=1.5/3×100%=50%.


科目:高中化学 来源: 题型:
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行相关实验。

请回答:
(1)装置 A 中发生的化学反应方程式为________________________。
(2)装置 D 中试管口放置的棉花中可以浸上NaOH溶液, 其作用是_____________。
(3)装置 B 的作用是贮存多余的气体。当 D 处有明显的现象后,关闭旋塞 K 并移去酒精灯。B 中应放置的液体是(填字母) ____。
a.水 b.酸性 KMnO4 溶液 c.饱和 NaHSO3 溶液 d.浓溴水
(4)实验中,取一定质量的铜片和一定体积 18 mol·L—1 的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。有一定量的余酸但未能使铜片完全溶解,你认为可能的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现用二氧化钛(TiO2)作催化剂可以使水在光照条件下分解制得廉价的氢气,这使氢能源的研究和应用更向前迈进了一步。下列说法正确的是( )
A.使用二氧化钛作催化剂使水快速分解的同时放出大量热
B.催化剂的作用是通过改变反应的活化能来影响反应速率
C.该反应的原理是:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.每产生氢气44.8L,转移电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W在医药和新材料等领域有广泛应用,其合成路线如图所示:

已知以下信息:
①1molY完全反应生成2molZ,且在加热条件下Z不能和新制的氢氧化铜反应
② +R1COOH
+R1COOH
③R1CH2NH2 +H2O(R1、R2、R3代表烃基)
+H2O(R1、R2、R3代表烃基)
回答下列问题:
(1)Y的化学名称是___________,Z中的官能团名称是___________。
(2) 中___________(填“有”或“无”)手性碳原子,①的反应类型是___________。
中___________(填“有”或“无”)手性碳原子,①的反应类型是___________。
(3)反应③所需的试剂和条件是___________。
(4)反应⑤的化学方程式为___________。
(5)G是对硝基乙苯的同分异构体,G能和碳酸氢钠反应产生气体且分子中含有氨基(-NH2),G的可能结构共有___________种(不考虑立体结构);其中核磁共振氢谱为五组峰,峰面积比为2:2:2:2:1的结构简式为___________。
(6)已知氨基(-NH2)易被酸性KMnO4溶液氧化。设计由甲苯和丙酮为原料制备药物中间体![]() 的合成路线:___________(无机试剂任选)。
的合成路线:___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了下图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱。供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
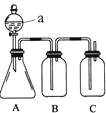
(1)仪器a的名称:________。
(2)锥形瓶中装有某可溶性正盐,a中所盛试剂为________。
(3)装置B所盛试剂是____________________,其作用是_____________。
(4)装置C所盛试剂是_______________,
C中反应的离子方程式是________________。
(5)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.透明的溶液中: Fe3+、Al3+、CO32-、SO42-
C.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
D.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa;②0.1mol·L-1NaClO;③0.1mol·L-1Na2CO3;④0.1mol·L-1NaHCO3四种溶液的pH由大到小的关系为________________。(用序号填空)
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-=10-ymol·L-1,x与y的关系如图所示。

①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_______。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按甲方式混合后,所得溶液的pH为____________;
按乙方式混合后,其反应的离子方程式:_________________。
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种芳香酯类物质,也是一种重要的香料,工业上合成它的一种方法如下图所示。图中D的相对分子质量为106,D、E的核磁共振氢谱均只有两个峰,B经过氧化可以得到C。

已知:![]() R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
(1)A的结构简式为___________________________,D的名称是___________________。
(2)D→E的反应类型为_______________,“一定条件”的内容是__________________。
(3)B中官能团的名称是__________,G的结构简式为___________________________。
(4)E→F的化学方程式为_________________。
(5)符合下列条件的F的同分异构体共有________种,写出一种核磁共振氢谱有5个峰的同分异构体的结构简式:________________________________。
①遇FeCl3溶液能发生显色反应 ②含有醚键
(6)写出以乙烯为原料合成HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com