
| A、1:1:1 |
| B、2:1:1 |
| C、1:2:1 |
| D、3:2:1 |
| ||
| 2 |
| 3 |
| 1.24g |
| 62g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、乙烯水化制得乙醇 |
| B、甲烷与绿气制备一氯甲烷 |
| C、铜和浓硝酸为原料生产硝酸铜 |
| D、乙酸与乙醇制乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
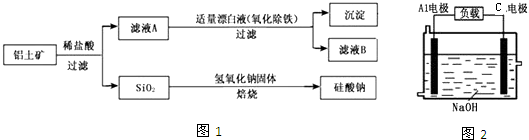

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题 | ||||||
| B、加速建设城市地铁、轻轨等轨道交通,促进城市一体化发展,减少汽车尾气排放 | ||||||
| C、发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统 | ||||||
D、尽量使用含
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 |
| 1 |
| 2 |
| 3 |
| 2 |
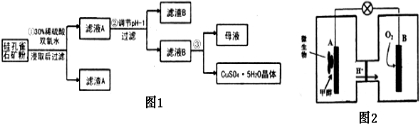
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、采用绿色工艺,使原料尽可能转化为所需物质 |
| B、大量开采地下水,以满足社会需求 |
| C、开发利用绿色能源替代化石燃料 |
| D、严格执行机动车尾气排放标准 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
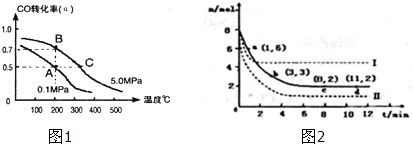
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com