
| A. | 对二甲苯 | B. | 均三甲苯 | C. | 乙酸异丙酯 | D. | 乙二酸二乙酯 |
分析 在核磁共振氢谱中能出现两组峰,说明该分子中含有两类氢原子,且其峰面积之比为3:1,说明这两类氢原子的个数比是3:1,据此分析解答.
解答 解:A.对二甲苯的结构简式为: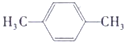 ,该分子的核磁共振氢谱中有两组峰,其峰面积之比是3:2,故A错误;
,该分子的核磁共振氢谱中有两组峰,其峰面积之比是3:2,故A错误;
B.均三甲苯的结构简式为: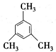 ,该分子的核磁共振氢谱中有两组峰,其面积之比是3:1,故B正确;
,该分子的核磁共振氢谱中有两组峰,其面积之比是3:1,故B正确;
C.乙酸异丙酯的结构简式为:CH3COOCH(CH3)2,该分子的核磁共振氢谱中有三组峰,其峰面积之比是6:3:1,故C错误;
D.乙二酸二乙酯的结构简式为:CH3CH2OOCCOOCH2CH3,该分子的核磁共振氢谱中有两组峰,其峰面积之比是6:4=3:2,故D错误,
故选B.
点评 本题考查有机物的结构,明确核磁共振氢谱中吸收峰的组数、面积之比的含义是解本题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2+H2SO4═BaSO4↓+2H2O既是放热反应又是氧化还原反应 | |
| B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O反应物的总能量低于生成物的总能量 | |
| C. | C(石墨)$\frac{一定条件}{\;}$C(金刚石)是吸热反应,所以金刚石比石墨更稳定 | |
| D. | 吸热反应和放热反应都遵守能量守恒定律 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能改变反应速率 | B. | 升高温度能加快反应速率 | ||
| C. | 降低压强能减小反应速率 | D. | 改变压强对反应速率没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2,SiO2,Al2O3均为酸性氧化物 | B. | 稀豆浆,雾,氯化铁溶液均为胶体 | ||
| C. | 漂白粉,水玻璃,氨水均为混合物 | D. | 烧碱,冰醋酸,乙醇均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分离乙醇和乙酸乙酯 | |
| B. |  分离苯和甲苯 | |
| C. |  实验室制备,收集乙烯并验证其易被氧化 | |
| D. |  实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从试剂瓶中取出的某些特殊药品,若有剩余可以放回原试剂瓶 | |
| B. | 配制一定质量分数的硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| C. | 称量NaOH固体时,在托盘天平的两个托盘上各放一张质量相同的滤纸,将NaOH固体放在左盘滤纸上称量 | |
| D. | 配制一定物质的量浓度溶液过程中,定容摇匀后发现液面低于刻度线,再补加少量蒸馏水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | CaCO3+2HCl=CaCl2+CO2↑+H2O | ||
| C. | 2Na2O2+2H2O=4NaOH+O2↑ | D. | Fe+CuSO4=FeSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
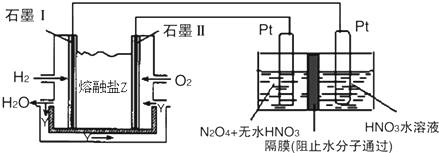
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com