
| 选项 | A | B | C | D |
| 电极材料 | Zn | Fe | Cu | Al |
| 电极材料 | Cu | Zn | Ag | C |
| 电解质溶液 | CuCl2溶液 | H2SO4溶液 | CuSO4溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:A.锌为活泼金属,可与氯化铜发生氧化还原反应,可形成原电池反应,故A错误;
B.锌比铁活泼,可与硫酸溶液发生氧化还原反应,可形成原电池,故B错误;
C.不能形成自发进行的氧化还原反应,不能形成原电池,故C正确;
D.铝比碳活泼,铝可与氢氧化钠溶液发生氧化还原反应,能形成原电池,故D错误;
故选C.
点评 本题考查了原电池的构成条件,为高频考点,侧重于基础知识的考查,难度不大,注意这几个条件必须同时存在才能形成原电池,缺一不可.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
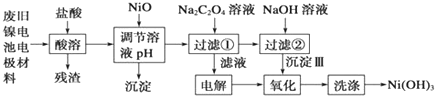
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、用电子式表示CJ2的形成过程:
、用电子式表示CJ2的形成过程: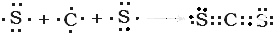
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 分别加水稀释10倍,四种溶液的pH ①>②>④>③ | |
| C. | VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=9:11 | |
| D. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| Z | W |
| A. | 常温下,四种元素单质中,全部是固体 | |
| B. | Z的阳离子与Y的阴离子电子层结构相同 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | W元素原子半径比Z元素原子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为  ③能与水在一定条件下反应 | ①由C、H两种元素组成 ②分子球棍模型为 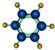 |
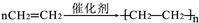 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与浓硝酸反应时,硝酸既表现氧化性又表现酸性 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入氯水,氯水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com