
| A. | 用盐酸滴定氢氧化钠溶液时,滴定前,酸式滴定管内无气泡,滴定后也无气泡 | |
| B. | 用盐酸滴定氢氧化钠溶液时,用甲基橙作指示剂,接近滴定终点,溶液由黄色转变为橙色,但不足半分钟又转为黄色,继续滴加盐酸,溶液颜色又转变为橙色,持续半分钟后颜色不变 | |
| C. | 某学生要配制0.1 mol•L-1的稀硫酸100 mL,当加蒸馏水到离容量瓶刻度线1~2 cm处时,改用胶头滴管滴加,结果不慎使液面稍稍超过刻度线一点,将多余部分吸出,使凹液面最低点与刻度线相切 | |
| D. | 物质的量浓度为0.05 mol•L-1的NaOH标准溶液因与空气接触吸收了少量CO2,用此标准液滴定未知物质的量浓度的HCl溶液 |
分析 A.滴定前,酸式滴定管内无气泡,滴定后也无气泡,标准溶液的体积没有误差;
B.达到滴定终点时,溶液颜色发生突变,并且半分钟内不恢复原来的颜色;
C.配制溶液时加水超过刻度线,溶液的体积偏大;
D.如用甲基橙为指示剂,溶质只有NaCl,对实验没有影响.
解答 解:A.滴定前,酸式滴定管内无气泡,滴定后也无气泡,标准溶液的体积没有误差,所以操作不会引起实验偏差,故A不选;
B.用盐酸滴定氢氧化钠溶液时,用甲基橙作指示剂,接近滴定终点,溶液由黄色转变为橙色,但不足半分钟又转为黄色,继续滴加盐酸,溶液颜色又转变为橙色,持续半分钟后颜色不变,说明恰好达到滴定终点,所以没有产生实验偏差,故B不选;
C.配制溶液时加水超过刻度线,溶液的体积偏大,硫酸的浓度偏小,操作一定会引起实验偏差,故C选;
D.甲基橙变色的PH范围是3.1~4.4,用甲基橙作指示剂滴定后溶液呈酸性,滴定时Na2CO3全部反应生成NaCl,由钠元素守恒可知,NaOH加盐酸生成NaCl,对实验没有影响,故D不选.
故选C.
点评 本题考查实验方案的评价,侧重学生的分析、实验能力的考查,主要把握溶液配制、酸碱中和滴定的实验原理和操作方法,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
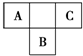 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | 物质WY2、W3X4、WZ4均有熔点高、硬度小的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

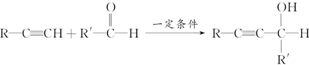
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
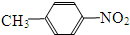 和
和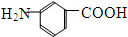 E、35Cl和37Cl
E、35Cl和37Cl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检测时,电解质溶液中的H+向负极移动 | |
| B. | 若有0.2mol电子转移,则消耗2.24L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应是:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡;试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
 2H2O+O2↑.
2H2O+O2↑.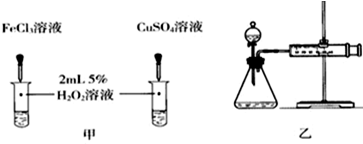
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com