
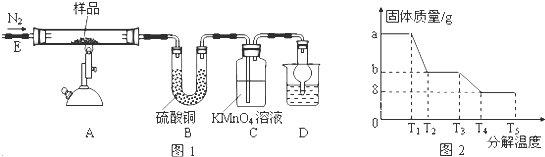
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
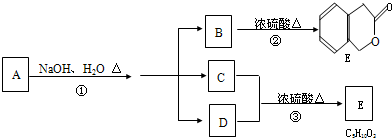
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、至少存在CO32-、Cl-中的一种 |
| B、Cl-一定存在,K+可能存在 |
| C、Cl-一定存在,且c(Cl-)≥0.6mol?L-1 |
| D、溶液中至少存在4种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
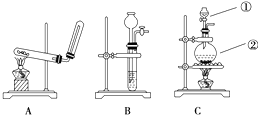
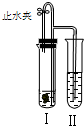 如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )
如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )| A | B | C | D | |
| Ⅰ | CaCO3、稀HCl | Na2CO3、稀H2SO4 | Zn、稀H2SO4 | Cu、稀H2SO4 |
| Ⅱ | KNO3 | NaCl | BaCl2 | Ba(OH)2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
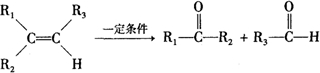
查看答案和解析>>
科目:高中化学 来源: 题型:
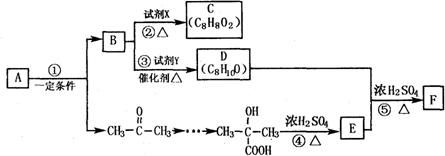
查看答案和解析>>
科目:高中化学 来源: 题型:
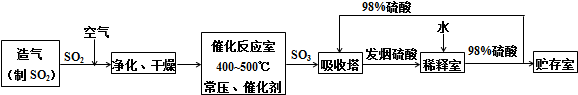
查看答案和解析>>
科目:高中化学 来源: 题型:
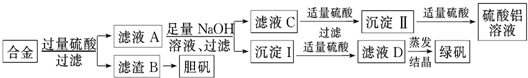
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com