
| A. | OH-+2CO32-+3H+→2HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+3H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
分析 等物质的量浓度的NaOH和Na2CO3的混合溶液中含有氢氧化钠与碳酸钠的物质的量相等,稀盐酸加入到NaOH和Na2CO3的混合溶液中,盐酸先与氢氧化钠发生酸碱中和,剩余的盐酸再与碳酸钠发生反应,盐酸少量时发生反应CO32-+H+=HCO3-,盐酸过量时发生反应:CO32-+2H+=CO2↑+H2O,以此来解答.
解答 解:A.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸少量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+H+→HCO3-,将两个方程式相加得:OH-+CO32-+2H+→HCO3-+H2O,故A错误;
B.设NaOH和Na2CO3的物质的量都为2mol,则加入盐酸少量,先发生反应:2OH-+2H+→2H2O,2mol氢氧化钠消耗2mol盐酸,再发生反应CO32-+H+→HCO3-,盐酸不足之消耗1mol碳酸钠,将两个方程式相加得:2OH-+CO32-+3H+→HCO3-+2H2O,故B正确;
C.设NaOH和Na2CO3的物质的量都为2mol,2mol氢氧化钠消耗2mol氢离子,剩余2mol氢离子与2mol碳酸钠反应生成2mol碳酸氢根离子,离子方程式应为2OH-+2CO32-+4H+→2HCO3-+2H2O,即OH-+CO32-+2H+→HCO3-+H2O,故C错误;
D.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸过量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+2H+→CO2↑+H2O,将两个方程式相加得:OH-+CO32-+3H+→CO2↑+2H2O,故D正确;
故选BD.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握反应的先后顺序、与量有关的离子反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 以惰性材料为电极,KOH溶液为电解质构成原电池,负极反应式为H2-2e-=2H+ | |
| B. | 铜、锌在稀硫酸溶液中构成原电池,正极反应式为2H++2e-=H2↑ | |
| C. | 以铜为电极将2Fe3++Cu=2Fe2++Cu2+设计成原电池,正极反应式为Cu-2e-=Cu2+ | |
| D. | 以铝、铁为电极,在氢氧化钠溶液中构成原电池,负极反应式为Al-3e-=Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最易失去的电子能量最高 | |
| B. | L层电子比K层电子能量高 | |
| C. | p轨道电子能量一定高于s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
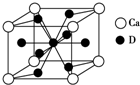 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO3 2-离子数之和为0.1NA | |
| B. | 标准状况下,22.4LC2H4与C3H6混合气体所含有分子数为NA | |
| C. | 1molNa2O2与足量的CO2反应转移的电子数为2NA | |
| D. | 18gNH4+所含的电子数11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定次数 | 盐酸的体积/mL | KOH溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )
15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )| A. | 在A、B间任意一点(不包括A、B两点):c(K+)>c(A-)>c(OH-)>c(H+) | |
| B. | 在B点:c(A-)=c(K+)>c(OH-)=c(H+),且a=7.5 | |
| C. | 在C点:c(A-)>c(K+)>c(OH-)>c(H+) | |
| D. | 在D点:c(A -)+c(HA)>2 c(K+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com