


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.330 kJ | B.276.67 kJ |
| C.130 kJ | D.76.67 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =-890kJ/mol |
B. CH4(g)+O2(g)= CH4(g)+O2(g)= CO2(g)+H2O(l) △H=-445kJ/mol CO2(g)+H2O(l) △H=-445kJ/mol |
C. CO2(g)+H2O(l)= CO2(g)+H2O(l)= CH4(g)+O2(g) △H= +445kJ/mol CH4(g)+O2(g) △H= +445kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-55.625kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
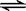 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )| A.196.64kJ | B.98.32kJ | C.>196.64kJ | D.<196.64kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是
2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是| A.吸收18.4KJ热量 | B.放出73.6KJ热量 |
| C.放出18.4KJ热量 | D.吸收73.6KJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H+ + CN-, K(1)Θ =" 4.9" ×10-10
H+ + CN-, K(1)Θ =" 4.9" ×10-10 NH4+ + OH-, K(2)Θ =" 1.8" ×10-5
NH4+ + OH-, K(2)Θ =" 1.8" ×10-5  H+ + OH-, KwΘ =" 1.0" ×10-14算出NH3 + HCN
H+ + OH-, KwΘ =" 1.0" ×10-14算出NH3 + HCN  NH4+ + CN-, 反应平衡常数的K值是_________________
NH4+ + CN-, 反应平衡常数的K值是_________________查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
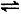 2SO3(g) ?Η=-197kJ/mol。在此温度下,向甲、乙两个固定容积的密闭容器中分别通入2molSO2、1molO2和1mol SO2、0.5molO2,反应达到平衡状态时放出的热量分别为Q甲和Q乙,则下列关系正确的是
2SO3(g) ?Η=-197kJ/mol。在此温度下,向甲、乙两个固定容积的密闭容器中分别通入2molSO2、1molO2和1mol SO2、0.5molO2,反应达到平衡状态时放出的热量分别为Q甲和Q乙,则下列关系正确的是| A.Q乙=0.5Q甲 | B.Q乙< 0.5Q甲 | C.Q乙<Q甲=197kJ | D.Q甲=Q乙<197kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com