
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离原子核较近的区域内运动的电子能量较高 | |
| C. | P、S、Cl非金属性和最高价氧化物对应的水化物的酸性均依次增强 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
分析 A、O、F无正价;
B、多电子原子中,在离核较近的区域内运动的电子能量较低;
C、因P、S、Cl同周期,且原子序数依次增大,则电子能力和最高价氧化物对应水化物的酸性均依次增强;
D、过渡元素包含副族元素与第Ⅷ族元素.
解答 解:A、O、F无正价,故A错误;
B、多电子原子中,在离核较近的区域内运动的电子能量较低,故B错误;
C、因P、S、Cl同周期,且原子序数依次增大,则电子能力和最高价氧化物对应水化物的酸性均依次增强,故C正确;
D、位于金属和非金属分界线附近的元素,表现一定的金属性与非金属性,而过渡元素包含副族元素与第Ⅷ族元素,故D错误,
故选C.
点评 本题考查结构性质位置关系的应用,难度不大,侧重对基础知识的巩固,A选项为易错点.


科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:实验题
锌是一种过渡金属,外观呈现银白色,在现代工业中对于电池制造上有不可磨灭的地位。现代炼锌的方法可分为火法和湿法两大类.硫酸铅是生产锌的副产品。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1473-1573K,使锌蒸馏出来。将闪锌矿焙烧使它转化为氧化锌的主要化学反应方程式为。
(2)某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
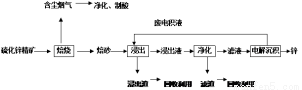
回答下列问题:
①焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
②浸出液“净化”过程中加入的主要物质为锌粉,其作用是。
③改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________
(3)工业冶炼锌的过程中,会产生铅浮渣(主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质),某科研小组研究利用铅浮渣生产硫酸铅的流程如下:
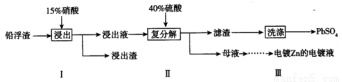
已知:25℃时,Ksp(CaSO4)=4.9×10-5,KSP(PbSO4)=1.6×10-8。
①已知步骤Ⅰ有NO气体产生,浸出液中含量最多的阳离子是Pb2+。写出Pb参加反应的化学方程式_____________________。
②步骤Ⅰ需控制Pb的用量并使Pb稍有剩余,目的是使Ag留在浸出渣中,产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去附着在硫酸铅表面的微溶物硫酸钙。沉淀转化反应的离子方程式是___。
③母液中可循环利用的溶质的化学式是_____________(填一种物质)
(4)现向含Pb2+、Ca2+浓度均为0.10mol/L的混合溶液中滴加0.10mol/LSO42-溶液.当Pb2+沉淀完全时,溶液中Ca2+浓度为mol/L
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:推断题
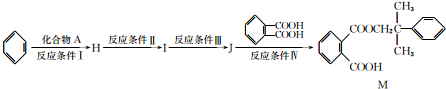
有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应;F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与足量的NaOH溶液反应后的产物,其一氯代物只有一种。
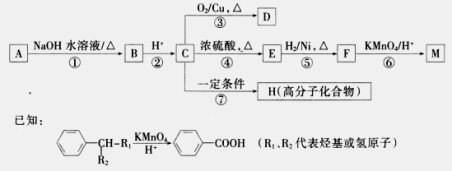
请回答:
(1)B、F的结构简式分别为____________、。
(2)反应①~⑦中,属于氧化反应的是________(填反应序号)。
(3)写出反应④的化学方程式__________________。
(4)D与新制Cu(OH)2悬浊液反应的化学方程式为_______________________。
(5)A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,下列确定该官能团的哪些实验方法是正确的________。
A.取少量A于试管中,再加入苯振荡,观察分液后上层溶液颜色
B.取少量A于试管中,再加入NaOH溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
C.取少量A于试管中,再滴入AgNO3溶液,再加入稀硝酸.观察沉淀颜色
D.取少量A于试管中,再加入NaOH的醇溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
(6)符合下列条件的F的同分异构体共有______种。
A.能发生银镜反应
B.能与FeCl3溶液发生显色反应
C.核磁共振氢谱上有四个峰,其蜂面积之比为l:1:2:6
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

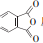 反应可生成1mol百里酚酞
反应可生成1mol百里酚酞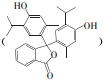

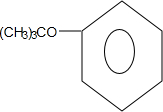
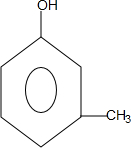 +CH3CH=CH2$\stackrel{AlCl_{3}}{→}$
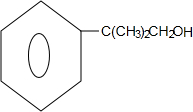
+CH3CH=CH2$\stackrel{AlCl_{3}}{→}$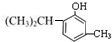 ;B→C的化学方程式为2(CH3)2CH2CH2CHO+O2$→_{△}^{催化剂}$2(CH3)2CH2CH2COOH.
;B→C的化学方程式为2(CH3)2CH2CH2CHO+O2$→_{△}^{催化剂}$2(CH3)2CH2CH2COOH.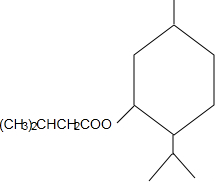 .
. .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| A | CO2 | SO2 | 澄清石灰水 |
| B | HCl | CO2 | Ba(OH)2 |
| C | CO2 | SO2 | Ba(NO3)2 |
| D | CO2 | NH3 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
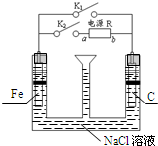
| A. | 若只关闭K1,则Fe发生析氢腐蚀 | |
| B. | 先只关闭K1,漏斗内液面下降,且有红褐色沉淀产生;再打开K1,仅关闭K2,则液面上升 | |
| C. | 若只关闭K2,只有一个电极产生气体,则a为电源负极 | |
| D. | 只关闭K1时,发生的总反应方程式为:2Fe+O2+2H2O═2Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
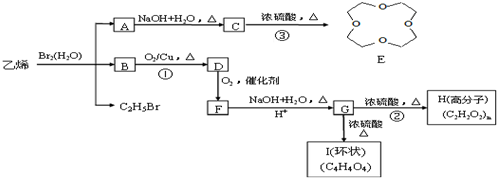
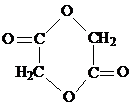 .
.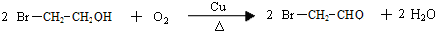 .写出反应 ②的化学方程式
.写出反应 ②的化学方程式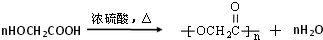 .
.查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:选择题
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示。
则下列说法正确
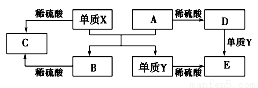
A.单质X与A反应的化学方程式:Al2O3+2Fe Fe2O3+2Al
Fe2O3+2Al
B.检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应.又能与碱反应,所以两者均是两性化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com