
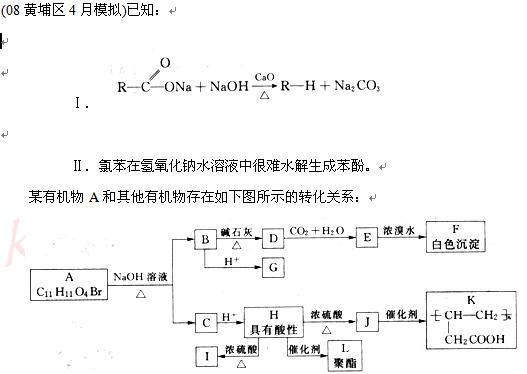
又知:A的水溶液显酸性,遇FeCl3溶液不显色,A分子结构中不含甲基,含苯环,苯环上的一氯代物只有两种;I是五元环状化合物,I和J互为同分异构体;K和L都是医用高分子材料。
试回答下列问题:
(1)写出F、J的结构简式:
F_________________________________;J_______________________________。
(2)写出下列反应的类型:E→F _______________ ; H→L_________________。
(3)写出下列反应的化学方程式:
①H→I__________________________________________________________________;
②J→K__________________________________________________________________;
③A→B+C________________________________________________________________。
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:阅读理解






查看答案和解析>>
科目:高中化学 来源: 题型:
AxByCz是由A、B、C三种处于不同短周期元素组成的化合物。
已知:① X、Y、Z均为正整数;且X+Y+Z=13;②取0.05mol该化合物与过量水反应产生2.4g气体M,同时生成0.05mol白色胶状沉淀R,R既能溶于盐酸,又能溶于氢氧化钠;③同温同压下,20mol由B、C两种元素组成的M气体完全燃烧需40mol氧气,产物为二氧化碳和水。
求:(1)三种元素的名称是A 、B 、C
(2)气体M的分子式是 该分子的空间构型是
(3)沉淀R溶于NaOH的离子方程式 R溶于NaOH后的产物水溶液显 性(填:酸、碱、中),原因是(用离子方程式表示
。
(4)实验室制取R的最佳方法是(用离子方程式表示):
(5)AXBYCZ与水反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
AxByCz是由A、B、C三种处于不同短周期元素组成的化合物。
已知:① X、Y、Z均为正整数;且X+Y+Z=13;②取0.05mol该化合物与过量水反应产生2.4g气体M,同时生成0.05mol白色胶状沉淀R,R既能溶于盐酸,又能溶于氢氧化钠;③同温同压下,20mol由B、C两种元素组成的M气体完全燃烧需40mol氧气,产物为二氧化碳和水。求:
(1)三种元素的名称是A 、B 、C
(2)气体M的分子式是 该分子的空间构型是
(3)沉淀R溶于NaOH的离子方程式 R溶于NaOH后的产物水溶液显 性(填:酸、碱、中),原因是(用离子方程式表示
。
(4)实验室制取R的最佳方法是(用离子方程式表示):
(5)AXBYCZ与水反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:![]()
![]() 混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 ①
①![]() 的△H 0(填“>”
的△H 0(填“>”
或“<”);若在恒温、恒压条件下向上述平衡体系中 通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,
则K1 K2;反应进行到状态D时,V正 v逆
(填“>”、“<”或“=)
 (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与
b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则:
c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示该混合溶液中一水合出氨的电离平衡常数表达式 。
(3)1000℃时,硫酸钠与氢气发生下列反应:
Na2SO4(s) + 4H2(g) ![]() Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性
(4)25℃时,已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为 。(填序号)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
材料1 向可溶性铝盐溶液中加入氨水,会生成白色的胶状氢氧化铝沉淀,该沉淀既可溶于强酸之中,又可溶于强碱之中,因此是一种两性氢氧化物。有人认为,氢氧化铝之所以具有两性,原因是在水中存在下列酸式电离和碱式电离的有关平衡:H++![]() +H2O
+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-。
Al3++3OH-。
材料2 在共价键中有一种价键与一般的形成方式不同,即一方(设为A方)提供两个电子,另一方(设为B方)具有接受两个电子的空轨道,从而形成如下一种特殊化学键:A→B。这样的共价键叫做配位键。如![]() 和H3O+中各有一个共价键是配位键,用“→”表示,箭头指向没提供电子的原子。即:
和H3O+中各有一个共价键是配位键,用“→”表示,箭头指向没提供电子的原子。即:

同共价键一样,配位键可以存在于分子之中(如H2SO4、AlCl3等),也可以存在于离子之中(如![]() )。
)。

材料3 已知气态氯化铝分子以双聚形式存在,其中Al—Cl键为共价键,其结构式如上图中间结构所示。图中“Cl→Al”表示Cl原子提供了一对电子与Al原子共享。又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。
(1)通过对有关信息的学习,你对于硼酸只是一元酸是怎样认识的?
你可以通过硼酸在水溶液中的电离平衡,来解释它只是一元酸的原因。你能写出下面方程式右端的两种离子的表达式吗?

(2)你对于材料1中氢氧化铝的有关电离方式是怎样认识的?你完全认可吗?如果不认可,你能写出你认为的铝酸的电离方程式吗?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com