随着环保意识的增强,清洁能源越来越受人们关注。
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源。
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO
2+2H
2O+ I
2=H
2SO
4+2HI
Ⅱ.2HI

H
2+I
2 Ⅲ.2H
2SO
4=2SO
2+O
2+2H
2O
分析上述反应,下列判断正确的是_________(填序号,下同)。
a.反应Ⅲ易在常温下进行
b.反应I中SO
2氧化性比HI强
c.循环过程中需补充H
2O
d.循环过程中产生1 mol O
2的同时产生1 mol H
2 ②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:
CH
4(g)+H
2O(g)=CO(g)+3H
2(g) ΔH =+206.1 kJ·mol
-1 若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH
4)=3.0 mol·L
-1;c(H
2O)=8.5 mol·L
-1;c(CO)=2.0 mol·L
-1;c(H
2)=2.0 mol·L
-1,则此时正逆反应速率的关系是v正___________(填“>”、“<”或“=”) v逆。
③实验室用Zn和稀硫酸制取H
2,反应时溶液中水的电离平衡____________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的_____________,产生H
2的速率将增大。
a.NaNO
3 b.CuSO
4 c.Na
2SO
4 d.NaHSO
3 (2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H
2(g)

CH
3OH(g) 分析该反应并回答下列问题:
①下列各项中,不能说明该反应已达到平衡的是______________。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH
3OH分解的速率和CH
3OH生成的速率相等
c.一定条件下,CO、H
2和CH
3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH
3OH
②如图是该反应在不同温度下CO的转化率随时间变化的曲线。

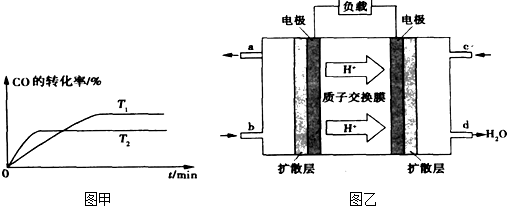
 H2+I2
H2+I2  CH3OH(g) 分析该反应并回答下列问题:
CH3OH(g) 分析该反应并回答下列问题: 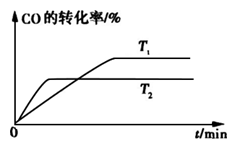

 H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O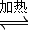 CH3OH(g)分析该反应并回答下列问题:
CH3OH(g)分析该反应并回答下列问题: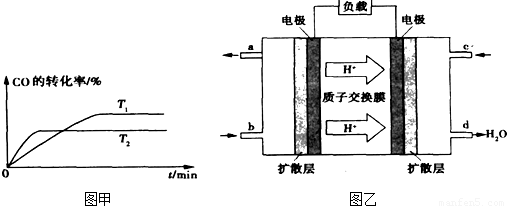
 H2+I2
H2+I2