
分析 以15g水为线索,先计算8.4g饱和硫酸铜溶液中含有硫酸铜、水的质量,然后根据剩余的水存在于蓝色五水合硫酸铜晶体,计算形成晶体所需硫酸铜的质量.
解答 解:8.4g饱和硫酸铜溶液中含有硫酸铜的质量为8.4g×$\frac{40g}{100+40g}$×100%=2.4g,溶剂水的质量为8.4g-2.4g=6.0g,
则15g-6g=9g水与硫酸铜结合形成五水合硫酸铜晶体,该晶体中含有硫酸铜的质量为9g×$\frac{160}{5×18}$=16g,
因此加入的无水硫酸铜的质量是2.4g+16g=18.4g,
故答案为:18.4g.
点评 本题考查了溶液中溶质的质量分数及其相关计算,难度中等,明确滤液为饱和溶液及理清水的去向是解题的关键.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯酚晶体隔绝空气密封保存 | |
| B. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| C. | 少量的钠保存在乙醇中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
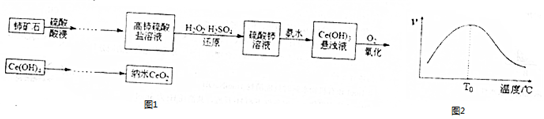
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaX |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 | |
| B. | ①中Se是氧化产物,I2是还原产物 | |
| C. | 反应①中KI是氧化剂,SeO2是还原剂 | |
| D. | 反应①中每有1.0mol I2生成,转移电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
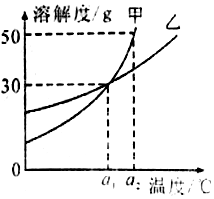
| A. | a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 | |
| B. | 甲和乙的溶解度相等 | |
| C. | a1℃时,甲和乙各30g分别加入100g的水中,均形成饱和溶液 | |
| D. | a2℃时,在100g水中加入60g甲,形成不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L乙烷分子中的碳原子数目为2NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OOH的物质的量 | |
| B. | 溶液中的n(H+) | |
| C. | 用同浓度的NaOH溶液恰好完全反砬,消耗NaOH溶液的体积 | |
| D. | 溶液的导电能力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com