
| A. | 少量SO2通入足量NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | 将氨通入稀硫酸中:NH3+H+═NH4+ | |
| C. | 在NaOH溶液中滴入NH4Cl溶液并加热:NH4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O | |
| D. | 向Ba(OH)2溶液中加入稀H2SO4恰好完全反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
分析 A.二氧化硫少量,反应生成亚硫酸钠和水;
B.氨气与硫酸反应生成硫酸铵;
C.在NaOH溶液中滴入NH4Cl溶液并加热反应生成氨气、氯化钠和水;
D.离子个数配比不符合物质结构.
解答 解:A.少量SO2通入足量NaOH溶液中,离子方程式:SO2+2OH-═SO32-+H2O,故A正确;
B.将氨通入稀硫酸中,离子方程式:NH3+H+═NH4+,故B正确;
C.在NaOH溶液中滴入NH4Cl溶液并加热,离子方程式:NH4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O,故C正确;
D.向Ba(OH)2溶液中加入稀H2SO4恰好完全反应,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选:D.
点评 本题考查离子反应方程式的书写,明确发生的化学反应即可解答,侧重反应的实质及离子反应中保留化学式的物质的考查,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO、P2O5都是非金属元素形成的氧化物,均为酸性氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有氧化性,都是氧化性酸 | |
| C. | BaCl2、Ca(OH)2、HNO3、HT 均为化合物 | |
| D. | HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
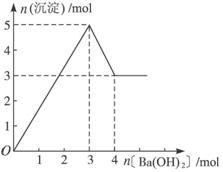 如图表示在某溶液中滴加Ba(OH) 2溶液时,沉淀的物质的量随Ba(OH) 2的物质的量的变化关系.该溶液的成分可能是( )
如图表示在某溶液中滴加Ba(OH) 2溶液时,沉淀的物质的量随Ba(OH) 2的物质的量的变化关系.该溶液的成分可能是( )| A. | MgSO 4 | B. | Al 2(SO 4) 3 | C. | Fe 2(SO 4) 3 | D. | NaAlO 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液保存在配有玻璃塞的细口瓶中 | |
| B. | 金属钠通常密封保存在煤油中 | |
| C. | 氯水通常保存在棕色细口瓶并置于阴凉处 | |
| D. | 氢氟酸保存在塑料试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:| 滴定次数 | 滴定起始读数(mL) | 滴定终点读数(mL) |
| 第一次 | 1.08 | 见右图 |
| 第二次 | 2.02 | 24.52 |
| 第三次 | 1.00 | 20.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com