
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |

分析 四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,Z最高正价与最低负价之和为零,则Z为Si元素,据此解答.
解答 解:四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,Z最高正价与最低负价之和为零,则Z为Si元素.
(1)Z是Si元素,处于第ⅣA族,故答案为:ⅣA;
(2)W形成的最高价氧化物的水化物是硝酸,X的最高价氧化物的水化物是氢氧化钠,Y的最高价氧化物的水化物是氢氧化铝,Z的最高价氧化物的水化物是硅酸,氢氧化钠和其他三种物质能反应,所以该元素是Na,故答案为:Na;
(3)①比较金属性强弱的方法有:金属元素最高价氧化物的水化物碱性强弱、金属之间的置换反应、和酸或水反应生成氢气的难易程度、形成的氯化物溶液酸性强弱等,故选:bc;
②电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al,
故答案为:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al;
(4)HN3的酸性与醋酸的相当,则HN3为弱酸,与NaOH发生中和反应,反应方程式为:HN3+NaOH═NaN3+H2O;等体积、等浓度,二者恰好反应,为NaN3溶液,NaN3溶液中N3-水解,溶液呈碱性,故溶液中离子浓度顺序为c(Na+)>c(N3-)>c(OH-)>c(H+),
故答案为:HN3+NaOH═NaN3+H2O;c(Na+)>c(N3-)>c(OH-)>c(H+);
(5)镁、铝和稀硫酸反应生成硫酸镁、硫酸铝和氢气,硫酸镁、硫酸铝和氢氧化钠溶液反应生成氢氧化镁、氢氧化铝,氢氧化铝和氢氧化钠反应生成偏铝酸钠,氢氧化镁和氢氧化钠溶液不反应,灼烧氢氧化镁固体,氢氧化镁分解生成氧化镁和水,所以最后所得固体是氧化镁.
a.根据n的量计算镁的质量,根据m、n计算铝质量,从而计算铝的质量分数,故正确;
b.根据镁、铝的质量及镁铝和稀硫酸反应生成氢气的量计算铝和镁质量,从而计算铝的质量分数,故正确;
c.根据n的质量计算镁的质量,根据镁的量计算镁和稀硫酸反应生成氢气的量,从而得出铝和稀硫酸反应生成氢气的量,故而得出铝的质量分数,故正确,
故选:abc.
点评 本题考查元素周期表及有关推断、实验的设计、分析及评价等,推断元素是解题关键,注意掌握金属性、非金属性强弱比较实验事实,难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| ① | 物质微粒数 | 阿伏加德罗常数 |
| ② | 标况下气体摩尔体积 | 标况下气体体积 |
| ③ | 溶剂的体积 | 溶质的物质的量浓度 |
| ④ | 溶液中溶质的质量分数 | 溶液的质量 |
| ⑤ | 非标况下物质的质量 | 物质的摩尔质量 |
| A. | ③ | B. | ③④ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验方法 | 观察到的现象 |
| 步骤1 | ||
| 步骤2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
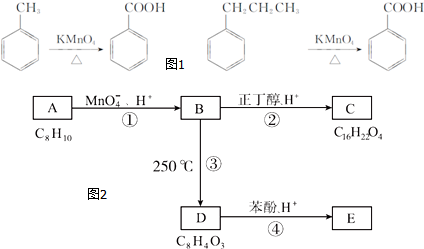
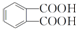 .
.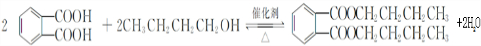 ,该反应的类型为取代反应.
,该反应的类型为取代反应.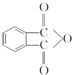 ,在D物质的核磁共振氢谱图中,会出现2组峰,峰面积之比为1:1.
,在D物质的核磁共振氢谱图中,会出现2组峰,峰面积之比为1:1.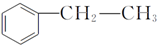 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
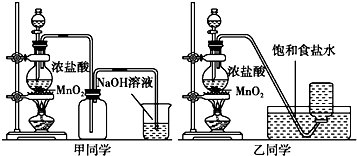
| 实验序号 | 实验操作 | 现象 | 结论 |
| ① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| ② | 加入NaHCO2粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的氢化物是同主族简单氢化物中沸点最低的一种 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y、Z的氢化物中化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室所制得的1.7gNH3中含有的电子数为0.1NA | |
| B. | 标准状况下2.24LHF中含有HF分子数为0.1NA | |
| C. | 1L0.1 mol•L-1NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 0.1mol氯酸钾与足量盐酸反应生成氯气转移电子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com