
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
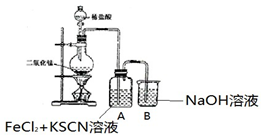 | I.A 中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
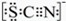
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
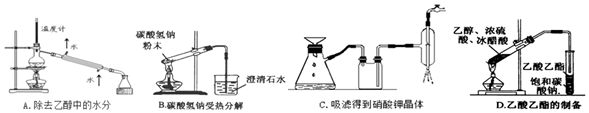
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{r({F}^{-})}{r(M{g}^{2+})}$ | B. | $\frac{r(N{a}^{+})}{r(M{g}^{2+})}$ | C. | $\frac{r(Cl)}{r(C{l}^{-})}$ | D. | $\frac{r(Na)}{r(N{a}^{+})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
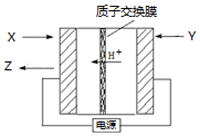 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | Y参与的电极反应为H2+2e-=2H+ | |
| B. | 反应过程中左边区域溶液pH逐渐升高 | |
| C. | 图中所示物质中,X为H2,Y为N2 | |
| D. | 当有3g H+通过质子交换膜时,Z的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列有关柠檬烯的说法正确的是( )
.下列有关柠檬烯的说法正确的是( )| A. | 该物质常温下为液态,易溶于水 | |
| B. | 它的苯环上的一氯化物有4种 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它可以发生加成、取代、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com