
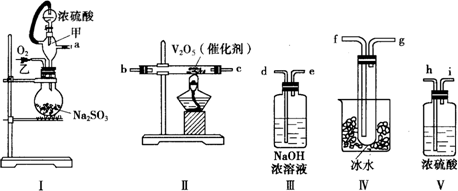
分析 (1)依据各装置作用排序:装置Ⅰ为气体发生装置,装置Ⅱ为二氧化硫催化氧化装置,装置Ⅲ为尾气吸收装置,装置Ⅳ为收集装置,装置Ⅴ干燥装置;
(2)甲仪器中橡皮管将分液漏斗与圆底烧瓶相连,使二者压强相等,有利于浓硫酸顺利滴入到烧瓶中;
(3)反应在加热条件下进行,为保证充分反应,应先加热;
(4)生成三氧化硫,经冷却可得到晶体;
(5)二氧化硫的转化率=$\frac{二氧化硫的变化量}{二氧化硫的初始总量}$×100%,根据硫元素守恒结合三氧化硫的量确定二氧化硫的变化量;
解答 解:(1)要制备二氧化硫并检验二氧化硫的性质、收集二氧化硫,依次用到的装置为:Ⅰ气体发生装置,Ⅴ干燥装置,Ⅱ为二氧化硫催化氧化装置,Ⅳ收集装置,Ⅲ尾气吸收装置,所以正确的顺序为:a h i b c f g d;
故答案为:a h i b c f g d;
(2)甲仪器中橡皮管将分液漏斗与圆底烧瓶相连,使二者压强相等,有利于浓硫酸顺利滴入到烧瓶中;
故答案为:使浓硫酸能顺利地滴入烧瓶中;维持烧瓶内压强与分液漏斗上方压强相等;
(3)为保证产生的二氧化硫尽可能多的转化为三氧化硫,应先加热V2O5,后缓缓滴入浓硫酸,
故答案为:先加热V2O5,后缓缓滴入浓硫酸;
(4)装置IV处是用来冷却三氧化硫气体,使之变成液态或固态,从而收集得到三氧化硫,所以可以在Ⅳ处看到有无色(或白色)晶体(或固体)生成,
故答案为:有无色(或白色)晶体(或固体)生成;
(5)n mol Na2SO3粉末与足量浓硫酸反应生成nmol二氧化硫,当反应结束时,Ⅲ处增重的部分为未反应的二氧化硫,则转化了的二氧化硫的质量为:64n-m,所以实验中SO2的转化率为$\frac{64n-m}{64n}$×100%,
故答案为:$\frac{64n-m}{64n}$×100%.
点评 本题考查物质的性质探究以及转化率的测定,把握实验的原理、物质的性质是解题关键,侧重于学生的分析能力和实验能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其一氯代物的结构简式是
,其一氯代物的结构简式是 ;其中一氯代物种类最多的是
;其中一氯代物种类最多的是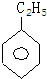 .(均填结构简式)
.(均填结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Mg(OH)2溶于硝酸:OH-+H+=H2O | |
| C. | Al与NaOH溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com