
| A、2.688 | B、4.48 | C、8.064 | D、8.96 |
| 6.12g |
| 17g/mol |
| 0.36mol |
| 5-2 |
| 0.36mol |
| 5-4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年东北三省三校高三第一次联合模拟考试理综化学试卷(解析版) 题型:选择题
6g Mg、Cu合金与一定量的硝酸恰好完全反应,收集到标准状况下VL NO和NO2的混合气体。向反应后的溶液中加入足量NaOH溶液,得到沉淀12.12g。则V的值可能是
A.2.688 B.4.48 C.8.064 D.8.96
查看答案和解析>>
科目:高中化学 来源: 题型:
Mg、Cu合金8.4g完全溶于浓硝酸中,若反应中硝酸被还原,只产生4480mLNO2和2240mLN2O4,反应后的溶液中加足量的NaOH溶液,生成的沉淀再经灼烧后所得固体质量为:
A.15.2 g, B.11.6g C.13.5g, D.16.6 g
【解析】根据反应过程不难判断,生成的沉淀是氢氧化镁和氢氧化铜,灼烧得到的是氧化镁和氧化铜,因为金属每失去2mol电子,就要结合1mol氧原子。硝酸的还原产物是NO2和N2O4,转移的电子是,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期期中考试化学试卷(解析版) 题型:选择题
Mg、Cu合金8.4g完全溶于浓硝酸中,若反应中硝酸被还原,只产生4480mLNO2和2240mLN2O4,反应后的溶液中加足量的NaOH溶液,生成的沉淀再经灼烧后所得固体质量为:
A.15.2 g, B.11.6g C.13.5g, D.16.6 g
【解析】根据反应过程不难判断,生成的沉淀是氢氧化镁和氢氧化铜,灼烧得到的是氧化镁和氧化铜,因为金属每失去2mol电子,就要结合1mol氧原子。硝酸的还原产物是NO2和N2O4,转移的电子是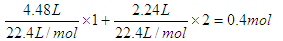 ,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com