
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:2015-2016学年福建省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列有关 、
、 、
、 说法错误的是
说法错误的是
A.是碳元素的三种同位素
B.是不同的原子
C.化学性质完全不同
D.其中的 14C和14N所含的质量数相等
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师范大学附属中学高三上学期期中考试化学试卷(解析版) 题型:实验题
某研究性学习小组的同学通过课外学习了解到:某品牌牙膏中含有摩擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂等成分,其中的摩擦剂除了含CaCO3外,可能还含有Al(OH)3、SiO2中的一种或两种。为探究该品牌牙膏中摩擦剂的成分,该小组的同学进行了如下实验(牙膏中其他成分遇到盐酸时无气体产生):

请回答下列问题:
(1)操作Ⅰ中涉及的玻璃仪器有烧杯、________、________
(2)写出下列操作Ⅳ的离子方程式:______________________________
(3)该摩擦剂中除CaCO3外,肯定含有__________________
(4)为进一步探究摩擦剂中碳酸钙的含量,该小组同学利用如图所示装置(图中夹持仪器略去)进行实验。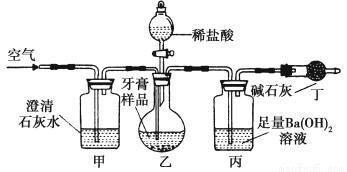
请回答下列问题:
①实验过程中需持续缓缓通入空气。其作用除了可充分混合装置乙和丙中的反应物外,还有________的作用;
②丙中主要反应的化学方程式是_______________
③实验中准确称取4.00 g样品三份,进行三次测定,测得BaCO3的平均质量为1.97 g,计算样品中碳酸钙的质量分数:__________________________
④有同学认为只要测定装置丙在吸收CO2前后的质量差,不必测定装置丙中生成的BaCO3质量,一样可以确定碳酸钙的质量分数。你认为该方案是否可行?________,简述理由:________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中考试化学试卷(解析版) 题型:选择题
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀或气体的物质的量。下列反应对应的曲线错误的是( )

A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向Na2CO3溶液中滴入盐酸至过量
D.向含有等物质的量的KOH、Ba(OH)2的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三第四次(12月)月考化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1
热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 mol。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。
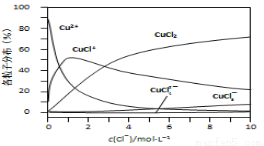
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
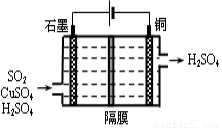
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用上图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江哈尔滨师大附中高三上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓) Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.向NaHSO4溶液中滴加Ba(OH)2溶液至碱性:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O
C.石灰乳与Na2CO3溶液混合:Ca2++ CO32-=CaCO3↓
D.NH4Cl浓溶液中滴加浓NaOH溶液并加热:NH4++OH- NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源:2016届贵州遵义航天高中高三上学期第三次模拟理综化学试卷(解析版) 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
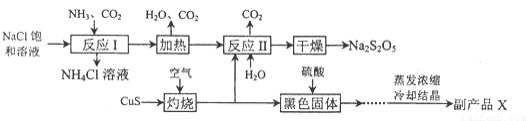
已知:反应II包含2NaHSO3=Na2S2O5+ H2O等多步反应。
(1)反应I的总化学方程式为 ,反应I进行时应先通入的气体是 ,反应I产生的NH4Cl可用作________。
(2)灼烧时发生反应的化学方程式为 ,若灼烧时生成SO21.12×l06 L(标准状况下),则转移电子 mol。
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为 。
(4)副产品X的化学式是 ,在上述流程中可循环使用的物质是____。
(5)为了减少产品Na2S205中杂质含量,需控制反应II中气体与固体的物质的量之比约为 ,检验产品中含有碳酸钠杂质所需试剂 。(填编号)。
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠 ④酸性高锰酸钾 ⑤稀硫酸
查看答案和解析>>
科目:高中化学 来源:2016届浙江宁波效实中学高三上学期期中考试化学试卷(解析版) 题型:推断题
某研究小组为了探究固体甲(二元化合物)和固体乙(无机矿物盐,含五种元素)的组成和性质,设计并完成了如下实验:

已知:向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解;向溶液2中连续通入气体2,也是先产生白色沉淀,后沉淀溶解。请回答下列问题:
(1)甲的化学式 ,气体1的结构式 。
(2)加热条件下,气体1与固体2反应,产物中有一种气体和一种固体,该反应的化学方程式为 。
(3)乙的化学式 。
(4)足量气体2与溶液1反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016宁夏回族自治银川一中高一上期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
①氧化还原反应的实质是元素的化合价发生改变
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 L HCl和1 L H2O的物质的量相同
④在熔融状态下可以导电的物质就是电解质
⑤利用丁达尔现象区别溶液和胶体
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A.除③外 B.④⑤⑥⑦⑧ C.⑤⑦⑧ D.①⑤⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com