
【题目】有下列几种方法制备O2:(l)KClO3和MnO2共热,(2)H2O2中加MnO2,(3)KMnO4受热分解,(4)Na2O2和水,若要制相同质量的O2,则上述反应中相关物质转移的电子数之比为
A. 3:2:4:1 B. 1:1:1:1 C. 2:1:2:1 D. 1:2:1:2
科目:高中化学 来源: 题型:
【题目】在生产和生活中,金属材料几乎无处不在。
(1)铝是一种活泼金属,具有较强的还原性。
①金属铝在高温下与三氧化二铁反应,2Al+Fe2O3=Al2O3+2Fe,称为铝热反应。试 用双线桥法表示电子转移情况:____________________。
②能否用铝制容器盛装NaOH溶液?________(填“能”或“不能”),
(2)将镁、铝的混合物共0.2 mol,溶于200 mL 4 mol·L﹣1的盐酸溶液中,然后再滴加2 mol·L﹣1的NaOH溶液。请回答下列问题:
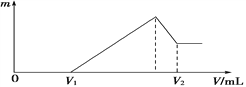
①若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160 mL时,则金属粉末中n (Al)=________________________mol。
②0~V1段发生的反应的离子方程式为______________________________;
③若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=_____________mL;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.能电离出氢离子的化合物叫做酸
B.能电离出氢氧根离子的化合物叫做碱
C.能电离出酸根离子的化合物叫做盐
D.由金属离子和酸根离子组成的化合物属于盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是 ( )
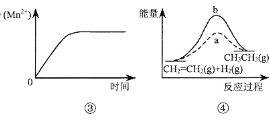
A.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
B.图④中a、b曲线分别表示反应CH2=CH2 (g)+ H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
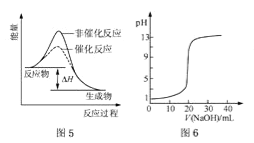
C.图5表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图6表示0.1000mol L-1NaOH溶液滴定20.00mL0.1000mol L-1CH3COOH溶液所得到的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______V2(填“>”、“=”或“<”)。
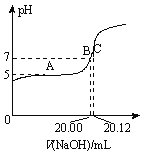
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________,CH3COOH溶液的实际浓度为____________。
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________。
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________。
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”)。
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A.加入10mL 0.01mol·L-1的NaOH溶液 B.加入10mL 的水进行稀释
C.加水稀释成100mL D.加入10mL 0.01mol·L-1的盐酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的沸点的排列顺序正确的是
①丁烷 ②2-甲基丙烷 ③正戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷
A. ①>②>③>④>⑤ B. ⑤>④>③>②>①
C. ③>④>⑤>①>② D. ②>①>⑤>④>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com