

| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 2.25 | 2.50 | 2.50 |
分析 (1)通入BH4-的一极为原电池的负极,发生氧化反应,BH4-失电子生成BO2-;电解时,阳极上N2O4失电子生成N2O5;
(2)N2O5与水反应生成HNO3;
(3)根据N2O5的浓度变化计算氧气的浓度变化;
(4)根据K=$\frac{c({O}_{2})×{c}^{2}({N}_{2}{O}_{4})}{{c}^{2}({N}_{2}{O}_{5})}$利用三段式法计算;
(5)降低N2O5分解率,则化学平衡向逆方向移动,根据影响平衡的因素判断.
解答 解:(1)过氧化氢的一极为原电池的正极,发生还原反应,通入BH4-的一极为原电池的负极,发生氧化反应,BH4-失电子生成BO2-,电极反应式为:BH4-+8OH--8e-=BO2-+6H2O;电解时,阳极上N2O4失电子生成N2O5,其电极方程式为:N2O4+2HNO3-2e-=2N2O5+2H+;
故答案为:BH4-+8OH--8e-=BO2-+6H2O;N2O4+2HNO3-2e-=2N2O5+2H+;
(2)在阳极上,N2O4失电子生成N2O5,如果水分子能够通过隔膜,水分子会和N2O5反应生成HNO3,则不能得到N2O5,所以隔膜不允许水分子通过;
故答案为:H2O 通过隔膜进入阳极,与N2O5反应生成HNO3;
(3)500s 时,△c(N2O5)=5.00-2.25=2.75mol•L-1,由方程式2N2O5 (g)?2N2O4(g)+O2(g)可知,c(O2)=1.375 mol?L-1;
故答案为:1.375 mol?L-1;
(4)t℃时,达到平衡状态时,c(N2O5)=2.50mol?L-1,
2N2O5 (g)?2N2O4(g)+O2(g)
起始(mol?L-1):5.00 0 0
转化(mol?L-1):2.50 2.50 1.25
平衡(mol?L-1):2.50 2.50 1.25
则K=$\frac{c({O}_{2})×{c}^{2}({N}_{2}{O}_{4})}{{c}^{2}({N}_{2}{O}_{5})}$=$\frac{1.25×2.5{0}^{2}}{2.5{0}^{2}}$=1.25;
故答案为:1.25;
(5)N2O5在一定温度下可发生分解反应:2N2O5 (g)?2N2O4(g)+O2(g)△H>0,
①该反应为吸热反应,升温化学平衡正向移动,N2O5的转化率增大,故不选;
②通入N2 对化学平衡无影响,N2O5的转化率不变,故不选;
③通入O2,O2的浓度增大,化学平衡逆向移动,N2O5的转化率降低,故选;
④通入N2O5,容器内压强大,化学平衡逆向移动,N2O5的转化率降低,故选;
⑤通入NO2,NO2会部分转化为N2O4,N2O4的浓度增大,化学平衡逆向移动,N2O5的转化率降低,故选;
故答案为:③④⑤.
点评 本题考查了原电池原理和电解原理的应用、化学平衡常数、平衡移动的影响因素等,题目难度中等,注意对化学平衡影响和反应速率影响因素及电化学知识的综合理解和运用,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:多选题
| A. | 原子半径:D>E>B>C>A | |
| B. | 热稳定性:EA4>A2C | |
| C. | 单质D可用海水为原料而获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 酚;
酚;  芳香烃;
芳香烃; 酯;
酯;  烯烃.
烯烃.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3L | B. | 2L | C. | 1L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
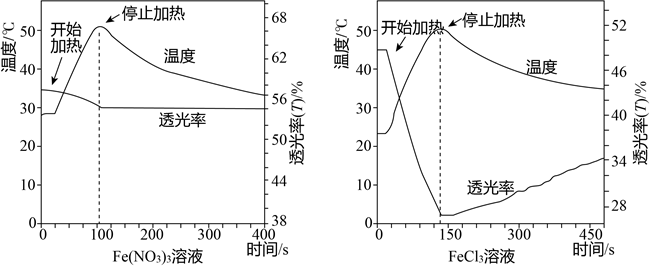
| 编号 | 实验 | 操作及现象 |
| a | 向Fe(NO3)3溶液(棕黄色)中加入大量HNO3 | i.溶液颜色非常浅 ii.加热和降温过程中透光率无明显变化 |
| b | 向FeCl3溶液(黄色)中加入大量HNO3 | i.溶液仍为黄色 ii.加热透光率下降,降温透光率上升 |
| 编号 | 实验 | 操作及现象 |
| c | 向Fe(NO3)3溶液中加入大量HNO3,再加入几滴NaCl溶液. | 测此溶液透光率随温度改变的变化情况,增加氯离子浓度,有色离子浓度增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

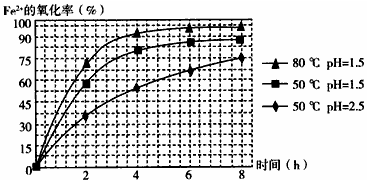
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com