


| 充电 |
| 放电 |



 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中同时滴入几滴KSCN溶液和少量新制氯水 溶液变为红色 原溶液一定含有Fe2+ |
| B、向AgCl的饱和溶液中加入少量NaCl晶体 无明显现象 NaCl溶于水,阻止了AgCl的溶解 |
| C、相同温度下,测定等物质的量浓度的Na2CO3和Na2SiO3两溶液的pH 后者的pH大 碳的非金属性比硅强 |
| D、在溴水中加入少量某有机物,充分振荡、静置 溴水褪色 该有机物中含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
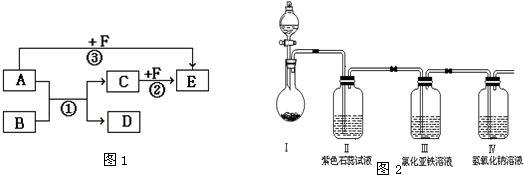
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0℃、1.01×105Pa时,22.4LSO3所含有的分子数目为NA |
| B、100mL0.1mol?L-1Ca(NO3)2溶液中Ca2+的数目是0.02NA |
| C、6.5g锌由原子变成离子时,失去的电子数是0.2NA |
| D、720g C60晶体中的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| B、钠在氯气中燃烧,生成白色的烟 |
| C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色的烟 |
| D、氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com