
| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离常数K(NH3•H2O)>K(HCN) | |
| B. | 室温时,相同体积、相同pH的盐酸和醋酸溶液中由水电离出的c(H+):盐酸小于醋酸溶液 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO2-4且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO2-4先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
分析 A、盐溶液水解时是谁强显谁性;
B、室温时,相同体积、相同pH的盐酸和醋酸溶液中,氢离子浓度相同,氢氧根浓度也相同,而两溶液中氢氧根均全部来自水的电离;
C、根据Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,求出向Cl-、CrO2-4且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时分别产生沉淀所需的c(Ag+),所需的c(Ag+)越小的越先产生沉淀;
D、pH=7的CH3COOH和NaOH混合溶液中,c(H+)=c(OH-),根据电荷守恒来分析.
解答 解:A、盐溶液水解时,溶液是谁强显谁性,而NH4CN溶液显碱性,故NH3•H2O的碱性强于HCN的酸性,则25℃时的电离常数K(NH3•H2O)>K(HCN),故A正确;
B、室温时,相同体积、相同pH的盐酸和醋酸溶液中,氢离子浓度c(H+)相同,根据水的离子积Kw=c(H+)•c(OH-)可知,氢氧根浓度c(OH-)也相同,而两溶液中氢氧根均全部来自水的电离,且水电离出的c(H+)=c(OH-),故两溶液中水电离出的c(H+)相同,故B错误;
C、由于Ksp(AgCl)=1.56×10-10,故Cl-浓度为0.010 mol•L-1溶液中滴加硝酸银溶液后,当生成AgCl沉淀时所需的c(Ag+)=$\frac{1.56×1{0}^{-10}}{0.01}$=1.56×10-8mol/L;
而Ksp(Ag2CrO4)=9.0×10-12,故向CrO2-4浓度均为0.010 mol•L-1溶液中逐滴加入AgNO3溶液时,产生沉淀所需的c(Ag+)=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$=3×10-5mol/L,而所需的c(Ag+)越小的越先产生沉淀,故Cl-先沉淀,故C错误;
D、pH=7的CH3COOH和NaOH混合溶液中,c(H+)=c(OH-),而根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故有c(Na+)=c(CH3COO-),故D错误.
故选A.
点评 本题综合考查了溶液中的离子平衡,全面涉及到了pH的计算、盐类水解的应用以及沉淀的溶解平衡,难度适中,是高考热点.


科目:高中化学 来源: 题型:选择题
| A. | 平衡正向移动 | B. | B的浓度增大 | C. | A的浓度减小 | D. | 逆反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤⑥ | C. | ②③④ | D. | ①⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(X)>r(R)>r(W) | |
| B. | X与Y只能形成一种化合物 | |
| C. | X的简单气态氢化物的热稳定性比Z的弱 | |
| D. | 由W、R、X三种元素组成的化合物可以是酸、碱或盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})•c({H}^{+})}$增大 | |
| B. | 通入CO2,或者加入少量氯化铵溶液,溶液pH均减小 | |
| C. | 升高温度,红色变深,平衡常数增大 | |
| D. | 加入NaOH固体,$\frac{c(HCO_3^-)}{{c(CO_3^{2-})}}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
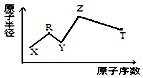 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | Y的单质易与R、T的氢化物反应 | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
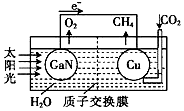 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 | |
| B. | Cu电极上的电极反应为CO2+8e-+8H+=CH4+2H2O | |
| C. | H+从左池移向右池 | |
| D. | 当装置中有1mol CH4生成时,GaN电极有44.8LO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
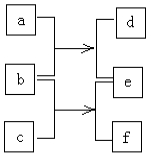 短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的单质或化合物的转化关系如图.b是金属单质,0.1mol•L-1d的pH为13,a和c是生活中常见的液态化合物,c的分子量为46.下列说法正确是( )
短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的单质或化合物的转化关系如图.b是金属单质,0.1mol•L-1d的pH为13,a和c是生活中常见的液态化合物,c的分子量为46.下列说法正确是( )| A. | 原子半径:Z>Y>X>W | |
| B. | Y与Z形成的两种常见化合物中阴阳离子个数比均为1:2 | |
| C. | b与c反应比b与a反应剧烈 | |
| D. | 元素W、Y形成的化合物的沸点一定比W、X形成的化合物高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com