
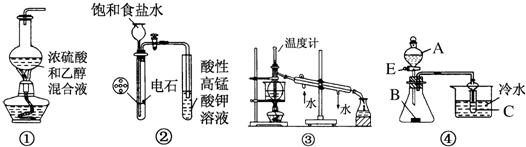
| A. | 图①用于实验室制乙烯 | |
| B. | 图②用于实验室制乙炔并验证乙炔发生氧化反应 | |
| C. | 图③用于实验室中石油的分馏 | |
| D. | 图④中若A为稀硫酸,B为纯碱(固体),C为苯酚钠溶液,则可验证硫酸、碳酸、苯酚酸性的强弱 |
分析 A.制备乙烯需要加热只170℃;
B.乙炔中混有硫化氢,均能被高锰酸钾氧化;
C.分馏时测定馏分的温度;
D.发生强酸制取弱酸的反应.
解答 解:A.制备乙烯需要加热只170℃,图中缺少温度计,不能完成实验,故A错误;
B.乙炔中混有硫化氢,均能被高锰酸钾氧化,不能检验乙炔,应先利用硫酸铜除杂,再利用高锰酸钾检验,故B错误;
C.分馏时测定馏分的温度,温度计的水银球应在烧瓶支管口处,且冷水方向不合理,故C错误;
D.发生强酸制取弱酸的反应,由装置及发生的反应可知,酸性为硫酸>碳酸>苯酚,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的制备、检验、混合物分离提纯、酸性比较等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾能水解生成氢氧化铝胶体,可用作净水剂 | |
| B. | 石英、玛瑙、水晶通常作为装饰品使用,但都可溶于氢氟酸 | |
| C. | Na2CO3俗称纯碱,可与盐酸反应,故可用于治疗人体内胃酸过多 | |
| D. | 农村施肥时,草木灰不能与铵态氮肥混用,以免氮肥肥效下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
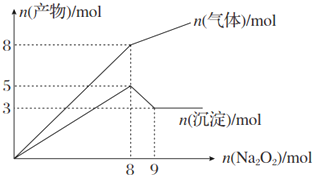
| A. | 2 mol、3 mol、4 mol | B. | 2 mol、3 mol、8 mol | ||
| C. | 3 mol、2 mol、8 mol | D. | 3 mol、2 mol、4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了“焰色反应”这一化学反应放出的能量 | |
| B. | 食盐中因为含有少量CaCl2、MgCl2晶体易潮解,它们潮解的实质是晶体表面吸水形成溶液 | |
| C. | 2013年11月,中科院国家纳米科学中心首次“拍”到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
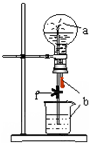 如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是 | a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 饱和NaHCO3溶液 |
| C | Cl2 | 饱和NaCl水溶液 |
| D | NH3 | NaNO3稀溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
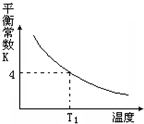 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
| Y | 2 | 1.80 | 1.66 | … | … | … | … |
| A. | 前5min用Z表示的平均反应速率为0.2 mol/(L•min) | |
| B. | 该反应的正反应是吸热反应,且T1>T | |
| C. | 若温度为T1时,以同样的起始量反应,达到平衡时X的转化率约为66.7% | |
| D. | 在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的转化率仍为50% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com