
分析 (1)C2H6与NO2发生反应生成二氧化碳、氮气和水;
(2)依据已知方程式构建目标方程式,结合盖斯定律书写热化学方程式,注意标注物质聚集状态和对应焓变;
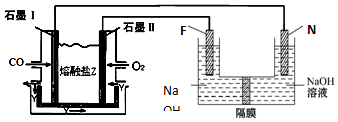
(3)石墨电极Ⅰ是原电池的负极,一氧化碳失去电子生成二氧化碳,滤液碳酸根离子配平电荷守恒;电解池中铁做阳极在氢氧化钠溶液中失电子生成Na2FeO4 ;
(4)在化学反应中,最高价元素只能得电子而作氧化剂,氧化剂具有氧化性,FeO42-在杀菌消毒过程中被还原为Fe3+,Fe3+水解成氢氧化铁胶体,吸附水中的悬浮杂质,从而达到净水的目的.
解答 解:(1)C2H6与NO2发生反应生成无毒的N2、CO2和H2O,反应为:4C2H6+14NO2$\frac{\underline{\;催化剂\;}}{\;}$8CO2+7N2+12H2O,
故答案为:4C2H6+14NO2$\frac{\underline{\;催化剂\;}}{\;}$8CO2+7N2+12H2O;
(2)已知:①CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
②2H2O (g)═2H2(g)+O2(g)△H=+484kJ/mol,
根据盖斯定律将①×2-②得2CO(g)+O2(g)═2CO2(g)△H=(-41kJ/mol)×2-484kJ/mol=-566 kJ/mol
故答案为:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol;
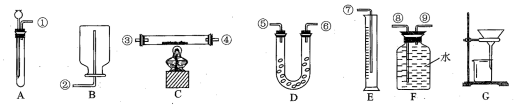
(3)现以CO、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备高铁酸盐Na2FeO4的装置如图所示,其中Y为CO2,
石墨电极Ⅰ是原电池的负极,一氧化碳失去电子生成二氧化碳,结合碳酸根离子配平电荷守恒,CO+CO32--2e-=2CO2,
电解池中铁做阳极在氢氧化钠溶液中失电子生成Na2FeO4 ,Fe-6e-+8OH-=FeO42-+4H2O,
故答案为:CO+CO32--2e-=2CO2;Fe-6e-+8OH-=FeO42-+4H2O;
(4)Na2FeO4消毒净水原理是铁+6价是最高价态,在杀菌消毒过程中被还原为Fe3+,Fe3+水解成氢氧化铁胶体,方程式为Fe3++3H2O?Fe(OH)3(胶体)+3H+,吸附水中的悬浮杂质,从而达到净水的目的,
故答案为:FeO42-在杀菌消毒过程中被还原为Fe3+,Fe3+水解成氢氧化铁胶体,吸附水中的悬浮杂质,从而达到净水的目的.
点评 本题考查热化学方程式得书写、原电池、电解池、氧化还原、胶体的性质等知识,掌握盖斯定律的应用以及电化学原理是解答关键,题目难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
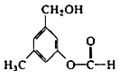 在一定条件下可以发生银镜反应
在一定条件下可以发生银镜反应 +CO32-→
+CO32-→ +HCO3-
+HCO3-| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲=乙>丙 | B. | 丙>甲=乙 | C. | 甲>乙>丙 | D. | 甲>丙>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 波长最长 | B. | 波长最短 | C. | 平均波长 | D. | 中间波长 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com