
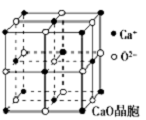
 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C
| ||
| ||
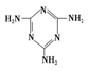 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (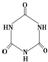 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过| 12 |
| 2 |


科目:高中化学 来源: 题型:
| A、所含质子数为(A-n) |
| B、所含中子数为(A-Z+n) |
| C、所含电子数为(Z-n) |
| D、中子数-电子数=A-2Z-n |
查看答案和解析>>
科目:高中化学 来源: 题型:
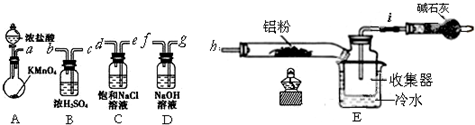
查看答案和解析>>
科目:高中化学 来源: 题型:
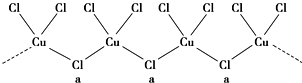
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、开放太阳能可以有效地减少“温室效应”的气体产生 |
| B、医用酒精的浓度越大,杀菌能力越强 |
| C、用灼烧的方法可以鉴别毛织物和棉织物 |
| D、苯酚能用于杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
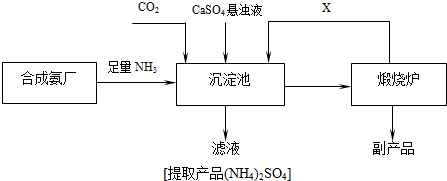
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2溶液、Ba(NO3)2溶液、NaCl溶液 |
| B、Na2CO3溶液、BaCl2溶液、MgCl2溶液 |
| C、Ba(NO3)2溶液、KCl溶液、MgCl2溶液 |
| D、Na2CO3溶液、K2CO3溶液、NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com