
| A. | 25℃时,pH=13的1LBa(OH)2溶液中含有OH-数目为0.2NA | |
| B. | 标准状况下,1.12LNO与1.12LO2的混合物中含有的原子数为0.2NA | |
| C. | 常温下,4.6g乙醇含有C-H键总数为0.6NA | |
| D. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氧原子数为0.3NA |
分析 A、依据pH计算氢离子浓度,结合溶液中离子积常数计算碱溶液中氢氧根离子浓度,水溶液中水电离也生成氢氧根离子分析判断;
B、依据标准状况n=$\frac{V}{22.4}$计算物质的量,结合原子守恒计算原子数;
C、根据n=$\frac{m}{M}$计算4.6g乙醇的物质的量,每个乙醇分子含有5个C-H键,进而计算C-H键物质的量,再根据N=nNA计算C-H键数目;
D、根据硝酸铵溶液中溶剂水含有氧原子判断.
解答 解:A、25℃时,pH=13的1.0L Ba(OH)2溶液中,碱含有的OH-数目为0.2NA,水存在电离生成氢氧根离子,所以溶液中氢氧根离子大于0.2NA,故A错误;
B、据标准状况n=$\frac{V}{22.4}$计算物质的量=$\frac{1.12L}{22.4L/mol}$=0.05mol,结合原子守恒计算原子数=(0.05mol×2+0.05mol×2)×NA=0.2NA,故B正确;
C、4.6g乙醇的物质的量为$\frac{4.6g}{46g/mol}$=0.1mol,每个乙醇分子含有5个C-H键,C-H键物质的量为0.1mol×5=0.5mol,含有C-H键数目为0.5mol×NAmol-1=0.5NA,故C错误;
D、由于硝酸铵溶液中,水分子中也含有氧原子,所以1L0.1mol•L-1的NH4NO3溶液中氧原子数大于0.3NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
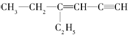 ,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8
,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8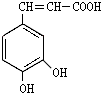 ),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好. .
.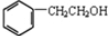 ,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为
,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为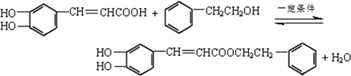 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有沉淀产生 | 蛋白质均发生变性 |
| D | 向某溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | R |
| W |
| A. | Z的氧化物与X单质不可能发生置换反应 | |
| B. | 五种元素的原子最外层电子数一定都大于2 | |
| C. | X、Z原子序数可能相差18 | |
| D. | Z可能是氯元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?N2O4 的△H>0 |
| D | 铝箔在酒精灯火焰上加热 | 铝箔熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃属于无机非金属材料 | B. | 煤的气化属于物理变化 | ||
| C. | 雾霾与汽车尾气的排放有关 | D. | 甲醛的水溶液可以用来浸泡标本 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
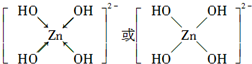 .
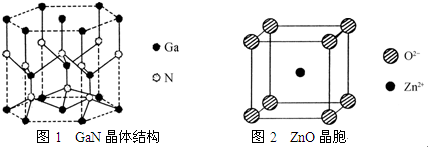
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
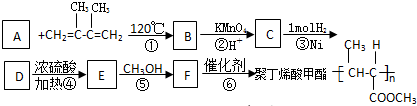
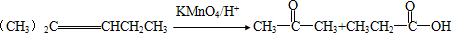

 ;D
;D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com