
����Ŀ��G��һ�ֳ����İ����ᣬ��ϳ�·����ͼ:
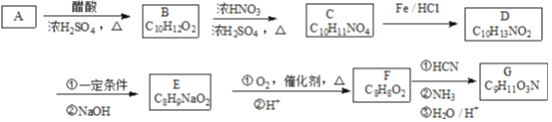
��֪������Ϣ:
��A������ֻ��1��ȡ�����Һ˴Ź���������6��壬�����֮��Ϊ1:2:2:2:2:1��D��F�ı����ϵ�һ�ȴ��ﶼֻ��2�֣�
��F��G����FeCl3��Һ������ɫ��Ӧ��F�ܷ���������Ӧ��
�� ��
��
�ش���������:
��1��B������Ϊ____________��
��2��F��G�Ĺ����Тٵķ�Ӧ������____________��
��3��B��C ��Ӧ�Ļ�ѧ����ʽΪ____________��
��4��G�Ľṹ��ʽΪ____________��
��5��F���б������ܷ���ˮ�ⷴӦ��ͬ���칹����____�֣����к˴Ź���������4�M�壬�����֮��Ϊ3:2:2:1����____________��
��6�����ձ����еĺϳ�·�ߣ�������ϩΪԭ�ϣ��ϳɱ�����(![]() )��д���ϳ�·�ߵ�����ͼ(���Լ�����ѡ) ________���ϳ�����ͼʾ������:
)��д���ϳ�·�ߵ�����ͼ(���Լ�����ѡ) ________���ϳ�����ͼʾ������:![]() ��
��
���𰸡� ���ᱽ���� �ӳɷ�Ӧ ![]()
![]() 6
6 ![]() (��
(��![]() ) CH2=CH2
) CH2=CH2![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO![]()
![]()
�����������������A����ᷢ��������Ӧ����B�����ݴ����B�ķ���ʽ���ƶ�A�ķ���ʽΪC8H10O��A������ֻ��1��ȡ����������˴Ź���������6��壬�����֮��Ϊ1:2:2:2:2:1����AΪ2-���Ҵ���BΪ���ᱽ������B�������õ�C��C����ԭ�õ�D��D�ڼ���������ˮ��õ�E��E�����������ữ��õ�F��F��G����FeCl3��Һ������ɫ��Ӧ����F��G�з��ǻ���F�ܷ���������Ӧ����F�л���ȩ����D��F�ı����ϵ�һ�ȴ��ﶼֻ��2������D��F�ı�������������Ϊ��λ��ȡ����������CΪ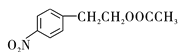 ��DΪ
��DΪ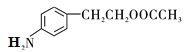 ��EΪ
��EΪ![]() �� FΪ
�� FΪ![]() ����F�Ľṹ�����Ϣ����֪��GΪ
����F�Ľṹ�����Ϣ����֪��GΪ![]() ��
��
��1��B������Ϊ���ᱽ������
��2����������Ϣ�ۿ�֪��F��G�Ĺ����Тٵķ�Ӧ�����Ǽӳɷ�Ӧ��
��3��B��C��Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��4��G�Ľṹ��ʽΪ![]() ��
��
��5��F��![]() �����б������ܷ���ˮ�ⷴӦ��ͬ���칹����
�����б������ܷ���ˮ�ⷴӦ��ͬ���칹����![]() ��
��![]() ��
��![]() ��
��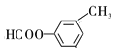 ��
�� ��
��![]() �� 6�֣����к˴Ź���������4�M�壬�����֮��Ϊ3:2:2:1����
�� 6�֣����к˴Ź���������4�M�壬�����֮��Ϊ3:2:2:1����![]() (��
(��![]() )��
)��
��6�����ձ����еĺϳ�·�ߣ���������ϩˮ�������Ҵ���Ȼ���Ҵ�������Ϊ��ȩ�������ȩ����������Ϣ�۵ķ�Ӧ���ɺϳɱ����ᡣ�ϳ�·�ߵ�����ͼ������CH2=CH2![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO![]()
![]() :��
:��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڿ���������˷�Ӧ��2H2S��O2==2S����2 H2O�����в���ȷ������ ��
A�������û���Ӧ B����ԭ����H2O> H2S
C����������O2> S D��������H2S> H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��DΪ���ֵ��ʣ�����ʱ��A��B�����壬C��D�ǹ��壮E��F��G��H��IΪ���ֻ����F����ˮ��EΪ�����Ҽ�����ˮ��Ϊ��ɫ��Һ��G����ˮ�û���ɫ��Һ����������ʼ䷴Ӧ��ת����ϵ��ͼ��ʾ 
��1��д�����ֵ��ʵĻ�ѧʽ ABCD
��2��д��H+B��G�����ӷ���ʽ��
��3��д��G+I��H+D+E�Ļ�ѧ����ʽ��
��4��ij������B��Ư�ۣ� ��д����Ư�۵Ļ�ѧ����ʽ ��
��Ϊ�ⶨ�ù����Ƶõ�Ư������Ч�ɷֵĺ�����ij��С�����������ʵ�飺��ȡƯ��3.0g����ĥ���ܽ⣬���ó�250mL��Һ��ȡ��25.00mL���뵽��ƿ�У��ټ��������KI��Һ���������ᣨ��ʱ���������ӷ���ʽΪ���������ã�����ȫ��Ӧ����0.2molL��1��Na2S2O3��Һ������Һ�ζ���Ӧ���ɵĵ⣬��֪��ӦʽΪ��2Na2S2O3+I2=Na2S4O6+2NaI������ȥNa2S2O3��Һ20.00mL�����Ư������Ч�ɷֵ���������Ϊ������С�������λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д�����ǣ� ��
A.ԭ�ӵĺ�����Ӳ������ڸ�Ԫ�����ڵ�������
B.Ԫ�����ڱ��д�IIIB�嵽IIB��10�����е�Ԫ�ض��ǽ���Ԫ��
C.�������ϡ������ԭ�ӵ���������������8
D.ͬһԪ�صĸ���ͬλ�ص��������ʡ���ѧ���ʾ���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪: 2SO2(g)+O2(g)![]() 2SO3(g) ��H=-XkJ/mol��
2SO3(g) ��H=-XkJ/mol��
2NO(g)+O2(g)![]() 2NO2(g) ��H=-YkJ/mol��
2NO2(g) ��H=-YkJ/mol��
��ӦNO(g)+SO2(g)![]() SO3(g)+NO(g) ����H=______ kJ/mol��
SO3(g)+NO(g) ����H=______ kJ/mol��
��2��������һ�ָ�Ч��������Դ��0.25mol������ȫȼ������Һ̬ˮʱ�ų�����222.5kJ�������ȼ�յ��Ȼ�ѧ����ʽΪ____________��
��3����KOH��ҺΪ�������Һ������(2)�з�Ӧ���һ��ԭ��أ��为����ӦʽΪ_______����H2SO4��ҺΪ�������Һ��������ȼ�ϵ���еļ����ΪC2H5OH���为����ӦʽΪ_________��
��4������������ȼ�ϵ��Ϊ��Դ���ò��缫���1LCu(NO3)2��KNO3�����Һ��ͨ��һ��ʱ��������������11.2L(��״��)���塣�������Һ��pHΪ______(����������Һ�������)��ԭ�����Һ��Cu2+�����ʵ���Ũ��Ϊ___________�����������������������Ϊ80%���ڼ���ȼ�ϵ�������ĵļ����ڱ�״���µ����Ϊ________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԭ���װ��ʾ��ͼ��
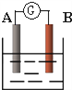
��1����AΪPb��BΪPbO2���������ҺΪH2SO4��Һ����ص��ܷ�ӦΪPb+PbO2+2H2SO4��2PbSO4+2H2O����õ���ڹ���ʱ��A�缫��������_______������ӡ�������С�����䡱�������õ�ط�Ӧ������0.1mol H2SO4����ת�Ƶ��ӵ���ĿΪ_______����NAΪ�����ӵ�������ֵ��
��2����A��B��Ϊ��Ƭ���������ҺΪKOH��Һ���ֱ��A��B����ͨ��CH4��O2���õ�ؼ�Ϊ����ȼ�ϵ�أ�д��A���ĵ缫��Ӧʽ��__________________________���õ�ع���һ��ʱ�����Һ�ļ��Խ�___________�����ǿ���������������䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ͷ�뵽�Ȼ�������Һ��,�ɹ۲쵽�������ǣ� ��
A. �������ɰ�ɫ���� B. �������ɺ��ɫ����
C. ���ճ��ֻ���ɫ���� D. �ޱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.����ڹ�����������ȼ�տ�������SO3
B.�����ó���ʯ��ˮ����CO2��SO2
C.������CO2ͨ��BaCl2��Һ�����ɰ�ɫ����
D.��������ˮ���ռ�SO2��NO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��(CuFeS2)����Ҫ�Ŀ�����Ի�ͭ��Ϊԭ��������ʽ�Ȼ�ͭ������(������)���ϵĹ���������ͼ��ʾ��

��1����Ӧ�������ӷ���ʽΪ_____________���÷�Ӧ����������________________��
��2����Ӧ�������ӷ���ʽΪ_________________________��
��3����Ӧ������45~50���������½��е���д���÷�Ӧ�Ļ�ѧ����ʽ��__________________��
��4����ʽ�Ȼ�ͭ�ж���������ɱ�ʾΪCua(OH)bClc��xH2O��Ϊ�ⶨij��ʽ�Ȼ�ͭ�������ijʵ��С���������ʵ����
����ȡ��Ʒ9.30g��������ϡHNO3�ܽ�����100.00mL��ҺA��
��ȡ25.00mL��ҺA����������AgNO3��Һ���õ�AgCl����1.435g��
����ȡ25.00mL��ҺA������pHΪ4~5����Ũ��Ϊ0.40mol��L-1��EDTA(Na2H2Y��2H2O)����Һ�ζ�Cu2+(���ӷ���ʽΪCu2++H2Y2-=CuY2-+2H+)���ζ����յ������ı���Һ50.00mL��ͨ������ȷ������Ʒ�Ļ�ѧʽΪ___________(�ѧʽ)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com