
| A. | ⑧② | B. | ⑥①⑤③ | C. | ④⑤⑨ | D. | ⑦①③⑨ |
分析 苯酚和乙醇混溶,直接蒸馏难以得到纯净物,可根据苯酚与NaOH反应的性质使之生成难挥发的苯酚钠,蒸馏之后再利用苯酚比碳酸酸性弱的特点通入二氧化碳气体生成苯酚,然后分液可得到分离的目的,以此来解答.
解答 解:苯酚和乙醇的沸点相差很小,直接用蒸馏的方法很难将其分开.应先加NaOH将苯酚转化为苯酚钠,苯酚钠是盐类物质,沸点和乙醇相差很大,因此控制温度可以用蒸馏法把乙醇排出,剩余的苯酚钠溶液中通入足量CO2,可以析出溶解度很小的苯酚,此时苯酚以乳浊液形式存在,待静止分层后再进行分液操作便可得到苯酚,则合理的步骤为⑥①⑤③,
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法等为解答的关系,侧重分析与应用能力及常见有机物性质的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生活中不能用粥汤检验碘盐中是否含有KIO3 | |
| B. | 减压过滤更适宜过滤胶状沉淀和颗粒较小的沉淀 | |
| C. | 通常用直接蒸馏的方法除去乙醇中的水 | |
| D. | 洗涤沉淀时,应用玻璃棒轻轻搅拌,使沉淀表面上的杂质溶于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O晶体和NH4Cl混合搅拌 | B. | 硫酸与氢氧化钠反应 | ||
| C. | 锌和盐酸反应 | D. | 氢气和氧气的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
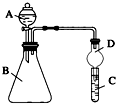 某同学为探究元素周期表中元素性质的递变规律,设计如图系列实验:
某同学为探究元素周期表中元素性质的递变规律,设计如图系列实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
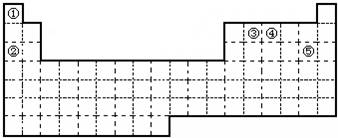
 ,试比较②和③原子半径的大小②>③(填“>”或“<”)
,试比较②和③原子半径的大小②>③(填“>”或“<”)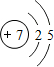 ,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)HNO3.
,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)HNO3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com