
【题目】近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。下图是以Cu作为催化剂CO2转化为甲酸的反应过程,下列有关说法不正确的是
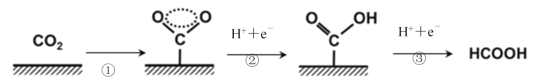
A.过程①说明在催化剂作用下,O-C-O之间形成了一种特殊的化学键
B.过程②和③吸收了能量并形成了O-H键和C-H键
C.CO2和HCOOH中均只含有极性共价键
D.每1molCO2完全转化为甲酸需得2mole-
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】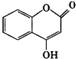 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成:
![]() 是一种气态烃,写出A的结构简式 ______ ;
是一种气态烃,写出A的结构简式 ______ ;
![]() 的反应类型是 ______ ;
的反应类型是 ______ ;
![]() 写出
写出![]() 的化学方程式 ______ ;
的化学方程式 ______ ;
![]() 下列关于G的说法正确的是 ______
下列关于G的说法正确的是 ______
![]() 能与溴单质反应
能与溴单质反应
![]() 能发生水解反应
能发生水解反应
![]() G最多能和5mol氢气反应
G最多能和5mol氢气反应
![]() 分子式是
分子式是![]()
![]() 写出满足以下条件的B的同系物所有同分异构体的结构简式 ______
写出满足以下条件的B的同系物所有同分异构体的结构简式 ______
![]() 分子式为
分子式为![]() 能发生银镜反应
能发生银镜反应![]() 能发生水解。
能发生水解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2NA
B.标况下,11.2 L H2O所含电子数为5NA
C.2.4 g镁变为镁离子时失去的电子数为0.1NA
D.常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,试回答:
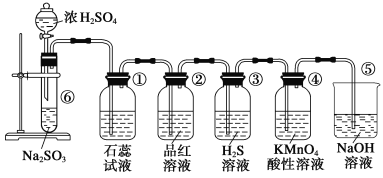
(1)在⑥中发生反应的化学方程式为___________。
(2)②中的品红溶液__________,证明SO2有________性。
(3)④中的实验现象是______,证明SO2有______性。
(4)⑤的作用是________,反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
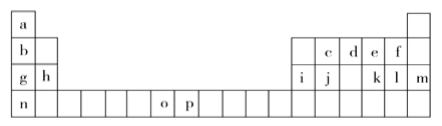
(1)基态o原子的外围电子排布图________________________;基态p3+的最外层电子排布式___________________;n的原子结构示意图____________________。在以上元素中,没有未成对电子的元素有______种。
(2)原子序数为52的元素x在元素周期表中与以上________________元素在同一族(填写以上表中字母对应的元素符号)。
(3)上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p),则I3(o)__I3(p)(填“>”或“<”)。理由是_________________________________________________。
(4)将以上周期表中g、h、i、j四种元素的电负性由大到小排序____________________(用元素符号表示),第一电离能由大到小排序________________________(用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在A处通入未经干燥的氯气。当关闭B阀时C处的红布条看不到明显现象;当打开B阀后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是( )
①饱和NaCl溶液②NaOH溶液③H2O④浓硫酸
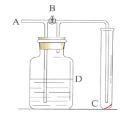
A.①B.①③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备乙炔和研究乙炔性质的实验装置图,下列有关说法错误的是( )
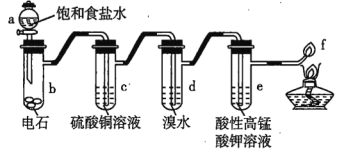
A.a中用饱和食盐水代替蒸馏水可使产生乙炔的速率更易控制
B.c中CuSO4 溶液的作用是除去影响后续实验的杂质
C.d、e中溶液褪色的原理不同,前者是氧化反应,后者是加成反应
D.f 处产生明亮、伴有浓烟的火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某化工厂用氯气与石灰乳生产漂白粉,该厂出厂产品说明书如下:

①漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式______,____。
②某实验室研究员将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,收集到标准状况下448 mL气体,则该漂白粉中所含有效成份的质量为_____________(假设漂白粉中的其它成份不与硝酸反应)。
(2)将14 g Na2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12 L,所得溶液的体积为400 mL。试计算:原混合物中Na2O的质量为______g,所得溶液的物质的量浓度为______ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验。
| 实验 | 条件 | 现象 |
ⅰ | 18℃ | 无明显气泡,0.5 min后有气体产生,一段时间后,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 | |
ⅱ | 65℃水浴 | 有气泡产生,12 s后,气泡非常明显,溶液很快转为红棕色,一段时间后,红棕色消失,最后产生红棕色沉淀 |
(1)实验ⅰ和ⅱ中均有气体产生,该气体为 ________。
(2)实验ⅱ中产生气体的速率明显快于实验ⅰ,可能的原因是________。
(3)“加铁氰化钾溶液有蓝色沉淀生成”说明混合溶液中存在________。
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化。研究小组猜想,可能是此实验条件下,氧化性H+>Fe3+。
查阅资料:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。根据资料小组同学设计了如下对比实验。
实验ⅲ | 实验ⅳ |
| _____________ |
①请在表格中画出实验ⅳ的装置图 。
②进行对比实验,观察到________,得出氧化性:Fe3+>H+。
研究小组进一步分析后,将Zn粒改为Zn粉,继续进行实验。
实验 | 条件 | 现象 |
ⅴ | 18℃,混合后不振荡 | 3 min后有明显的气泡产生,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
ⅵ | 18℃,混合后振荡 | 气泡不明显,红棕色褪色明显,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
③对比实验ⅴ和ⅵ,解释“气泡不明显,红棕色褪色明显”的可能原因:________。
(5)结合实验探究过程及现象,影响Zn与FeCl3溶液的反应过程的条件有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com