
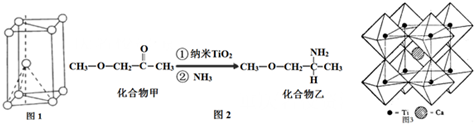
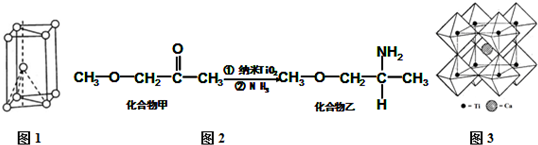
分析 I.(1)基态N原子中电子在2p轨道上的排布遵循的原则是洪特规则,N2F2分子中N原子之间形成N=N双键,N原子与F原子之间形成N-F键,N原子含有1对孤对电子;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大;
II.(3)核外电子没有运动状态相同的电子;由金属钛晶胞结构可知,属于六方最密堆积;
(4)化合物甲与化合物乙均为分子晶体,但化合物乙分子间可形成氢键;化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,同周期自左而右电负性增大;
(5)氧离子形成正八面体,钛离子位于正八面体中心.
解答 解:(1)基态N原子中电子在2p轨道上的排布遵循的原则是洪特规则,
N2F2分子结构式为F-N=N-F,分子中N原子含有1对孤对电子,N原子的杂化方式是sp2杂化,l mol N2F2含有3molσ键,即含有1.806×1024 个个σ键,
故答案为:洪特规则;sp2杂化;1.806×1024 ;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′,
故答案为:>;Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′;
Ⅱ(3)Ti原子核外电子数为22,核外共有22种运动状态不相同的电子;由金属钛晶胞结构可知,属于六方最密堆积;
故答案为:22;六方最密;
(4)化合物乙因分子间存在氢键,则化合物乙的沸点比化合物甲高,化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,同周期自左而右电负性增大,故电负性:O>N>C,
故答案为:化合物乙分子间形成氢键;O>N>C;
(5)氧离子形成正八面体,钛离子位于正八面体中心,钛离子被6个氧离子包围,
故答案为:6.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道与空间构型、化学键、氢键、电负性、晶胞结构等,注意理解键角大小的判断,注意氢键对物质性质的影响.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:推断题
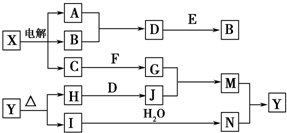 框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀.
框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
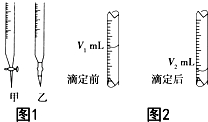 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7,且c(Na +)>c(OH -)>c(H +)>c(CH3COO-) | |
| B. | pH>7,且c(Na +)+c(H+)=c(CH3COO -)+c(OH-) | |
| C. | PH<7,且c(CH3COO -)>c(H+)>c(Na+)>c(OH-) | |
| D. | pH=7,且c(CH3COO -)=c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
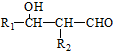
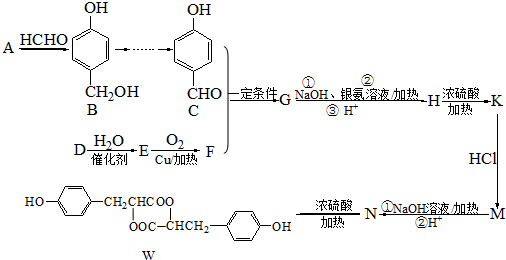
 .
.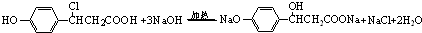 .
.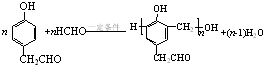 .
.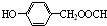 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 某溶液加入K3[Fe(CN)6]溶液 | 黑色沉淀生成 | 证明原溶液中存在Fe2+ |
| B | 某溶液加入HNO3、BaCl2混合液 | 产生白色沉淀 | 该溶液一定含有SO42- |
| C | 将水蒸气通过灼热的铁粉 | 粉末无变化 | 铁与水蒸汽高温下不反应 |
| D | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
做化学实验时,必须十分重视实验安全。下列有关实验操作不符合上述要求的是
A. 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度
B. 加热灼烧后的坩锅放置在实验桌上冷却至室温
C. 若不小心打翻酒精灯使酒精着火时,应用湿抹布盖灭
D. 蒸馏操作过程中,若发现忘加沸石,应立即停止加热,待烧瓶冷却后再加入沸石
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com