
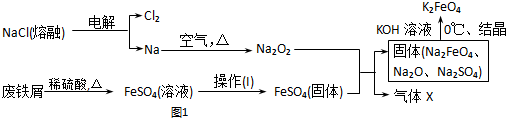
分析 (1)湿法制备高铁酸钾(K2FeO4),则FeO42-为产物,Fe(OH)3为反应物,化合价升高总共3价,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,化合价降低共2将,化合价升降最小公倍数为6,故Fe(OH)3的系数为2,FeO42-的系数为2,ClO-的系数为3,Cl-的系数为3,根据电荷守恒可知,OH-为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5,依据化学方程式定量关系计算;
(2)电解熔融氯化钠得到氯气和金属钠,钠在空气中燃烧生成过氧化钠,废铁屑加入稀硫酸加热反应得到硫酸亚铁溶液,通过蒸发浓缩、冷却结晶、过滤、洗涤得到硫酸亚铁晶体,隔绝空气减压干燥得到硫酸亚铁固体,硫酸亚铁固体和过氧化钠混合反应得到固体Na2FeO4,Na2SO4,Na2O,利用溶解度差异加入氢氧化钾溶液结晶得到K2FeO4,同时发出其X为O2,
①操作Ⅰ是硫酸亚铁溶液中得到硫酸亚铁晶体的过程需要蒸发浓缩,冷却结晶过滤洗涤,隔绝空气减压干燥得到硫酸亚铁固体;
②过程分析可知X为氧气;
③最终在溶液中得到K2FeO4晶体是利用K2FeO4在0℃时的溶解度下得到;
(3)步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol•L-1 (NH4)2Fe(SO4) 2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00mL.
①K2FeO4溶液具有强氧化性,应在酸式滴定管中量取;
②在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-,结合电荷守恒和原子守恒配平书写离子方程式;
③K2Cr2O7溶液为橙色、Fe3+的溶液为黄色;
④CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-;6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,依据反应的定量关系和铬元素守恒计算;
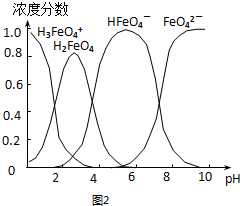
(4)A.PH=2时结合物料守恒分析判断;
B.根据图片知,改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小;
C.向pH=1的溶液中加HI溶液,HI具有还原性被高铁酸氧化;
D.不同PH值时,溶液中铁元素的存在形态及种数不相同,碱性溶液中存在FeO42-;
解答 解:(1)湿法制备高铁酸钾(K2FeO4),则FeO42-为产物,Fe(OH)3为反应物,化合价升高总共3价,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,化合价降低共2将,化合价升降最小公倍数为6,故Fe(OH)3的系数为2,FeO42-的系数为2,ClO-的系数为3,Cl-的系数为3,根据电荷守恒可知,OH-为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,该反应氧化剂与还原剂物质的量之比为3:2,
故答案为:3:2;
(2)①操作(I)是溶液中得到硫酸亚铁晶体的方法为:蒸发浓缩、冷却结晶、过滤、洗涤,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤;
②过程分析可知X为氧气,检验氧气的方法为:用带火星的木条接触气体,余烬的木条复燃证明是氧气,
故答案为:用带火星的木条接触气体;
③最终在溶液中得到K2FeO4晶体利用的原理是K2FeO4在0℃时的溶解度比Na2FeO4、NaOH、KOH、Na2SO4小,可以在饱和溶液中先析出晶体,
故答案为:K2FeO4在0℃时的溶解度比Na2FeO4、NaOH、KOH、Na2SO4小;
(3)①K2FeO4溶液具有强氧化性,准确量取25.00mL K2FeO4溶液加入到锥形瓶中应在酸式滴定管中量取,
故答案为:酸式滴定管;
②在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-,铬元素化合价+3价变化为+6价,铁元素+6价变化为+3价,结合电子守恒和电荷守恒配平得到离子方程式为:CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-,
故答案为:CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-;
③加入二苯胺磺酸钠作指示剂,用0.1000mol•L-1 (NH4)2Fe(SO4) 2标准溶液滴定至终点溶液显紫红色,不加指示剂因为K2Cr2O7溶液为橙色、Fe3+的溶液为黄色,颜色变化不明显,
故答案为:否,因为K2Cr2O7溶液为橙色、Fe3+的溶液为黄色,颜色变化不明显;
④CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-;6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,得到定量关系为:
2FeO42-~2CrO42-~Cr2O72-~6Fe2+,
2 6
n 0.0300L×0.1000mol/L
n=0.001mol,
100ml溶液中含有0.001mol×$\frac{100ml}{25ml}$=0.004mol,
测定该样品中K2FeO4的质量分数=$\frac{0.004mol×198g/mol}{1.0g}$×100%=79.2%,
故答案为:79.2%;
(4)A.图象分析可知pH=2时,溶液中存在物料守恒,存在形式为:H3FeO4+、H2FeO4、HFeO4-,所以0.1mol•L-1的K2FeO4溶液中存在物料守恒为:c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol•L-1,故A正确;
B.向pH=10的这种溶液中加硫酸铵溶液水解显酸性,图象变化可知,根据图片知,改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小,故B错误;
C.向pH=1的溶液中加HI溶液,HI具有还原性,发生反应的有氢离子、碘离子被氧化为碘单质,反应的离子方程式错误,故C错误;
D.将K2FeO4晶体溶于水,不同PH值时,溶液中铁元素的存在形态及种数不相同,碱性溶液中存在FeO42-,FeO42-属于弱酸阴离子水溶液中呈弱碱性,故D正确.
故答案为:A、D;
点评 本题考查学生阅读题目获取信息的能力、对工艺流程的理解与条件的控制、对物质的量浓度理解等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,注意基础知识的掌握.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:实验题
| 应量取的浓盐酸的体积/mL | 应选用的容量瓶的规格/mL | 除容量瓶外需要的其他仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用淀粉溶液检验溶液中是否存在碘单质 | |
| B. | 用分液漏斗分离乙酸乙酯与乙醇的混合物 | |
| C. | 用NaOH溶液除去乙酸乙酯中混有的乙酸 | |
| D. | 用排水集气法收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
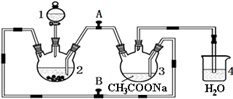 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
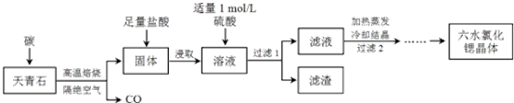
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑤⑥ | B. | ②⑤⑦⑥ | C. | ①③⑤⑦④⑥ | D. | ④③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠的电子式: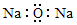 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: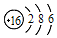 | |
| D. | CCl4的球棍模型: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com