
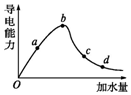
 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.分析 (1)溶液是通过离子的定向移动形成电流的;
(2)溶液的导电能力与离子浓度成正比;
(3)溶液越稀,醋酸的电离程度越大.
解答 解:(1)溶液是通过离子的定向移动形成电流的,冰醋酸中醋酸以分子存在,不存在离子,所以冰醋酸不导电,图中“O”点的氢离子浓度c(H+)=0,
故答案为:0;
(2)溶液的导电能力与离子浓度成正比,根据图象知,溶液导电能力大小顺序是d<c<a<b,则氢离子浓度由小到大顺序是d<c<a<b,溶液PH由大到小的顺序为为:故答案为:d>c>a>b,
故答案为:d>c>a>b;
(3)溶液越稀,醋酸的电离程度越大,根据图象知,溶液体积大小顺序是d>c>b>a,所以醋酸电离程度最大的是d,故答案为:d.
点评 本题考查了弱电解质的电离,明确溶液导电能力的影响因素、弱电解质电离程度与溶液浓度的关系是解本题关键,正确分析图象即可,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ④② | C. | ③② | D. | ③① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
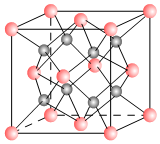 一种离子晶体的晶胞如图,其中阳离子A以
一种离子晶体的晶胞如图,其中阳离子A以  表示、阴离子B以
表示、阴离子B以  表示.
表示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有8个中子的碳原子${\;}_{8}^{14}$C | |
| B. | 铁红的化学式:FeO | |
| C. | NH4Cl的电子式为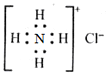 | |
| D. | Ca2+的结构示意图为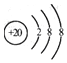 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 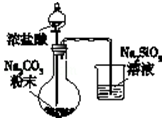 验证酸性:H2CO3>H2SiO3 | |
| B. | 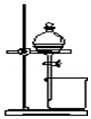 用于分离CCl4萃取碘水后的有机层和水层 | |
| C. | 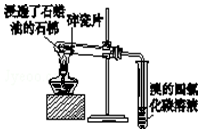 证明石蜡油分解生成的气体是乙烯 | |
| D. | 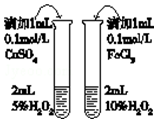 比较不同催化剂对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
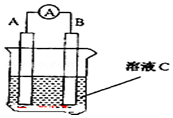 如图原电池装置图:
如图原电池装置图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
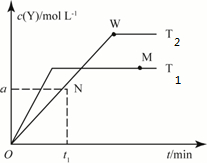 ( )
( )| A. | T2下,在0~t1时间内v(X)=$\frac{a}{{t}_{1}}$mol•L-1•min-1 | |
| B. | N点时气体的总压强大于W点时气体的总压强 | |
| C. | M点的正反应速率小于N点的逆反应速率 | |
| D. | W点时再加入一定量Y,平衡后X的转化率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com