
(每空2分,共12分)
PCl3与PCl5均是有机合成的重要中间体,两者存在以下相互转化关系:
PCl5(g)  PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
2L真空密闭容器中发生上述反应,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 |
n(PCl5) | 4 | 2.8 | 2 | 2 |
(1)已知上述反应在温度较高时才能自发进行,则a 0(填﹥、﹦、﹤);
(2)计算从20s至40s共20s的时间内,用PCl3表示的平均反应速率为 。210℃时该反应的平衡常数K值等于 。
(3)反应进行至60s后,将混合物的温度降低,重新达到平衡后氯气浓度将 (填“增大”、“减少”或“不变”)。
(4)欲增大该反应的K值,可采取的措施有(填序号)
A.降低温度 B.向混合气体中通入Cl2
C.使用高效催化剂 D.升高温度
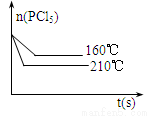
(5)如右图是210℃时容器中PCl5物质的量的变化曲线,请在该图中补画出该反应在160℃时PCl5物质的量的变化曲线。

(1) ﹥
(2)0.02mol·L-1·s-1。1mol·L-1(不带单位也给分)
(3)减少
(4)D
(5)
【解析】
试题分析:(1)PCl5(g)  PCl3(g) + Cl2(g) △S>0,且该反应在高温下自发,则△G=△H-T△S在高温下小于0,所以△H>0,该反应是吸热反应;
PCl3(g) + Cl2(g) △S>0,且该反应在高温下自发,则△G=△H-T△S在高温下小于0,所以△H>0,该反应是吸热反应;
(2)从20s至40s共20s的时间内,n(PCl5)减少2.8-2=0.8mol,所以PCl3的物质的量增加0.8mol,用PCl3表示的平均反应速率为0.8mol/2L/20s=0.02 mol·L-1·s-1;平衡时c(PCl5)=2mol/2L=1mol/L,PCl5的浓度减少4mol/2L-1mol/L=1mol/L,则平衡时c(PCl3)=c(Cl2)=1mol/L,所以平衡常数K= c(PCl3)×c(Cl2)/ c(PCl5)=1mol·L-1;
(3)该反应是吸热反应,温度降低,平衡逆向移动,所以再达平衡时氯气的浓度减少;
(4)平衡常数只与温度有关,温度高对正反应有利,平衡常数增大,所以欲增大该反应的K值,只能升高温度,答案选D;
(5)温度降低,反应速率减小,达到平衡的时间加长,同时平衡逆向移动,PCl5的物质的量增加,所以与210℃的图像相比,160℃的图像在210℃图像的上方,且后出现拐点,对应的图像见答案。
考点:考查对化学平衡常数、反应速率的计算,化学反应与能量的关系,化学平衡图像的描述


科目:高中化学 来源:2015届浙江省慈溪市、余姚市高三上学期期中联考化学试卷(解析版) 题型:选择题
下列化学反应中属于加成反应的是
A.CH2=CH2+HBr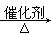 CH3CH2Br
CH3CH2Br
B.
C.2CH3CH2OH+O2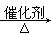 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH4+2Cl2 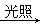 CH2Cl2+2HCl
CH2Cl2+2HCl
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3—等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
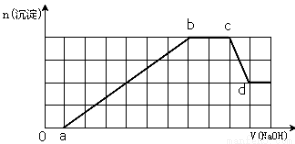
A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B.ab段发生的离子反应为:Al3++3OH—= Al(OH)3↓,Mg2++2OH—= Mg(OH)2↓
C.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+
D.d点溶液中含有的溶质只有Na2SO4
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
下列有关实验的操作正确的是
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使
用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
C.为观察Mg条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满 CO2气
体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部。
D.用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
生活中碰到的某些问题,常涉及到化学知识,下列说法不正确的是
A.Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂
B.近年来禽流感病毒H7N9时有病例报告,卫生部门强调要尽量避免接触活禽,个人也应加强消毒预防,其中消毒剂可以选用含氯消毒剂、酒精、双氧水等适宜的物质
C.食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质
D.碘的升华、溴水中萃取溴、石油的分馏均是物理变化
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%。现取20 mL pH=3 的 CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为
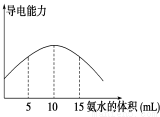
A.0.5% B.1.5% C.0.1% D.1%
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
下列热化学方程式中的△H能表示可燃物的燃烧热的是
A.2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=―Q2 kJ/mol
B.CH4(g)+2O2(g)==CO2(g)+2H2O(g); △H=-802.3kJ/mol
C.CO(g)+1/2O2(g)==CO2(g); △H=-283kJ/mol
D.2H2(g)+O2(g)==2H2O(1); △H=-571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是
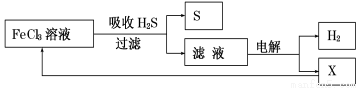
A.吸收H2S的离子方程式为:2Fe3++H2S =2Fe2++S↓+2H+
B.电解时选用阴离子交换膜,电解过程中的阳极区反应主要为:2Cl--2e- = Cl2
C.电解过程中若阴极产生2.24L气体,则阳极区产生0.2mol Fe3+
D.实验室可用点燃充分燃烧的方法消除H2S污染
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:填空题
(10分)1 000 mL某待测液中除含有0.2 mol/L的Na+外,还可能含有下列离子中的一种或多种:
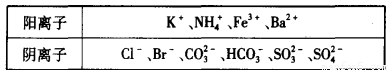
现进行如下实验操作(每次实验所加试剂均过量):
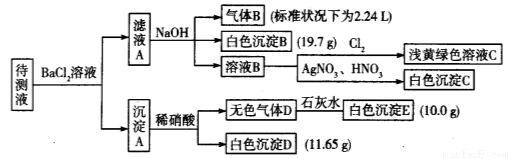
(1)写出生成白色沉淀B的离子方程式:___________________________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
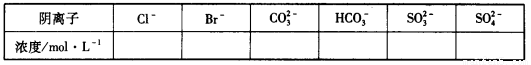
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:_______________________________________________________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________________。
②沉淀A中能与稀硝酸反应的成分是______________________________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com