
ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ä³ĆܱÕČŻĘ÷ÄŚ£¬SO2Ńõ»Æ³ÉSO3µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2SO2£Øg£©+O2£Øg£© 2SO3£Øg£© ”÷H £½£a kJ”¤mol£1”£ŌŚĻąĶ¬Ģõ¼žĻĀ£¬ŅŖĻėµĆµ½2a kJµÄČČĮ棬¼ÓČėø÷ĪļÖŹµÄĪļÖŹµÄĮææÉÄÜŹĒ(””””)
2SO3£Øg£© ”÷H £½£a kJ”¤mol£1”£ŌŚĻąĶ¬Ģõ¼žĻĀ£¬ŅŖĻėµĆµ½2a kJµÄČČĮ棬¼ÓČėø÷ĪļÖŹµÄĪļÖŹµÄĮææÉÄÜŹĒ(””””)
A£®4mol SO2ŗĶ2mol O2 B£®5mol SO2ŗĶ3mol O2
C£®4mol SO2ŗĶ4mol O2 D£®4mol SO2”¢2mol O2ŗĶ2mol SO3

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| AӢ1.8mol | BӢ2mol | CӢ2.2 mol | DӢ2.4mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
A.![]() mol B.
mol B.![]() mol C.
mol C.![]() mol D.
mol D.![]() mol
mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012ÄźĖÕ½Ģ°ęøßÖŠ»ÆѧєŠŽ2 2.3ĮņĖį¹¤ŅµĮ·Ļ°¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ä³ĆܱÕČŻĘ÷·¢ÉśČēĻĀ·“Ó¦£ŗ2SO2(g)+O2(g) 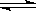 2SO3(g) £¬ ”÷H=
-98.3kJ/mol£¬·“Ó¦“ļµ½Ę½ŗāŗóSO2”¢O2”¢SO3µÄĪļÖŹµÄĮæÖ®±ČĪŖ3:2:5£¬±£³ÖĘäĖüĢõ¼ž²»±ä£¬ÉżĪĀŗóÖŲŠĀ“ļµ½Ę½ŗā£¬SO3”¢O2µÄĪļÖŹµÄĮæ·Ö±šĪŖ2¦Į molŗĶ¦Į mol£¬Ōņ“ĖŹ±ČŻĘ÷ÄŚSO2µÄĪļÖŹµÄĮæÓ¦ĪŖ£Ø £©”£
2SO3(g) £¬ ”÷H=
-98.3kJ/mol£¬·“Ó¦“ļµ½Ę½ŗāŗóSO2”¢O2”¢SO3µÄĪļÖŹµÄĮæÖ®±ČĪŖ3:2:5£¬±£³ÖĘäĖüĢõ¼ž²»±ä£¬ÉżĪĀŗóÖŲŠĀ“ļµ½Ę½ŗā£¬SO3”¢O2µÄĪļÖŹµÄĮæ·Ö±šĪŖ2¦Į molŗĶ¦Į mol£¬Ōņ“ĖŹ±ČŻĘ÷ÄŚSO2µÄĪļÖŹµÄĮæÓ¦ĪŖ£Ø £©”£
A£®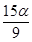 mol B£®
mol B£® mol C£®
mol C£®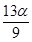 mol D£®
mol D£®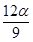 mol
mol
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com