
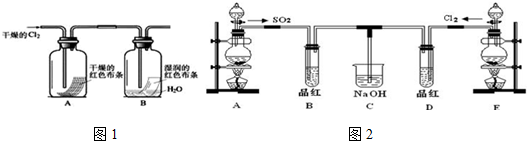
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;分析方程式中氯元素化合价变化,计算转移电子数目;
(2)浓盐酸具有易挥发性,制备的氯气中含有氯化氢和水蒸气,依据氯化氢、氯气在饱和食盐水中溶解度不同,浓硫酸具有吸水性选择合适的除杂剂;
(3)氯气不具有漂白性,氯气与水反应生成氯化氢和次氯酸,次氯酸具有漂白性,依据AB现象解答;
(4)①使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
②依据二氧化硫漂白性具有不稳定性,受热易恢复颜色,次氯酸漂白具有稳定性,受热不恢复颜色解答.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;依据方程式可知每生成1mol氯气,有4mol氯化氢参加反应,其中只有2mol氯化氢中-1价氯升高为氯气中0价,失去2mol电子,所以有4mol的HCl参加反应,则转移的电子总数为2NA;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;2NA;
(2)浓盐酸具有易挥发性,制备的氯气中含有氯化氢和水蒸气,依据氯化氢极易溶于水、氯气在饱和食盐水中溶解度不大,所以X试液为饱和食盐水,作用除去氯气中的氯化氢,浓硫酸具有吸水性选择合适的除杂剂,所以Y为浓硫酸,作用干燥氯气;
故答案为:A;除去氯气中混有的水蒸气(或干燥氯气);
(3)通入Cl2后,A中干燥布条不褪色,B中湿润布条褪色,可证明氯气不具有漂白性,氯气与水反应生成氯化氢和次氯酸,次氯酸具有漂白性,方程式:Cl2+H2O=HClO+HCl;
故答案为:Cl2+H2O=HClO+HCl 次氯酸有漂性;
(4)①使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,打开分液漏斗,发现其中的液体不能流下,可能的原因是分液漏斗瓶塞未打开;
故答案为:分液漏斗的玻璃塞没有取下来;
②二氧化硫漂白性具有不稳定性,受热易恢复颜色,次氯酸漂白具有稳定性,受热不恢复颜色,所以为区别二者可以进行如下操作:停止通气后,再给B、D两个试管分别加热;
故答案为:停止通气后,再给B、D两个试管分别加热.
点评 本题考查了二氧化硫与氯气的制取以及二氧化硫漂白与次氯酸漂白的区别,明确二者制备原理及漂白原理是解题关键,题目难度不大.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题
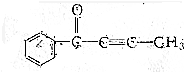 的有机化合物分子中:
的有机化合物分子中:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
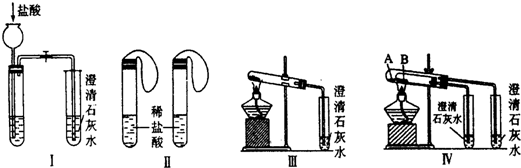
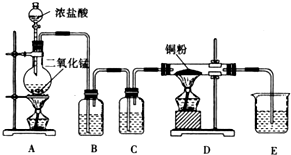 某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.
某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
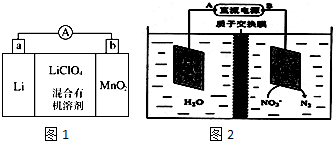
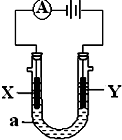 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  装置所示装置可实现反应:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 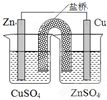 装置能构成锌铜原电池 | |
| C. | 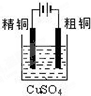 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于在实验室测定中和反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com