
| A. | 氯化氢的比例模型: | B. | Cl-的结构示意图: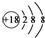 | ||
| C. | 氯乙烯的结构简式:CH2=CHCl | D. | HClO的电子式: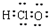 |
分析 A.H原子的原子半径小于Cl原子,则氢原子的相对体积小于氯原子;
B.氯离子质子数为17,核外电子数为18,有3个电子层,最外层电子数为8;
C.氯乙烯可以看作氯原子取代了乙烯中的1个H原子;
D.次氯酸中不存在H-Cl键,其中心原子为O原子.
解答 解:A.HCl分子是直线形分子,氯原子比氢原子大,氯化氢正确的比例模型为: ,故A错误;
,故A错误;
B.氯离子质子数为17,核外电子数为18,有3个电子层,最外层电子数为8,氯离子结构示意图为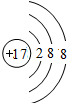 ,故B错误;
,故B错误;
C.氯乙烯分子中含有1个碳碳双键,其结构简式为:CH2=CHCl,故C正确;
D.次氯酸为共价化合物,中心原子为O原子,HClO正确的电子式为 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构简式、离子结构示意图、比例模型等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象等 |
| Ⅰ | 先向2mL 0.1mol/L FeC12溶液中滴加KSCN溶液,再滴加新制氯水 | ①滴加KSCN溶液后,溶液无明显变化;滴加新制氯水后,溶液变变成红色 ②FeC12溶液与新制氯水反应的离子方程式2Fe2++Cl2═2Fe3++2Cl- |
| Ⅱ | 先向2mL 0.1mol/L FeC13溶液中滴加KSCN溶液,再滴加0.1mol/L KI溶液 | 滴加KSCN溶液后,溶液变红色;滴加KI溶液后,红色无明显变化 |
| 编号 | 操作 | 现象等 |
| Ⅲ | 先向2mL 0.1mol/L KI溶液中滴加1mL 0.1mol/L FeC13溶液,再滴加KSCN溶液 | 滴加FeC13溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变为红色.根据实验现象可以推测出Fe3+有可能与I-发生了氧化还原反应. |
| 编号 | 操作 | 现象及结论 |
| Ⅳ | 向2mL 0.1mol/L KI溶液中滴加1mL 0.1mol/L FeC13溶液,再滴加①再滴加淀粉溶液(或CCl4;或铁氰化钾溶液) | 现象:溶液变蓝. 结论:Fe3+能与I-发生氧化还原反应生成②I2,③Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 酸性氧化物 | 碱性氧化物 | 酸 | 盐 |
| A | 碱石灰 | 二氧化硫 | 氧化铝 | 乙二酸 | 小苏打 |
| B | 五水硫酸铜 | 三氧化硫 | 氧化铜 | 油酸 | 苏打 |
| C | 过氧化氢 | 五氧化二磷 | 过氧化物 | 硬脂酸 | 碱式碳酸铜 |
| D | 盐酸 | 一氧化碳 | 氧化镁 | 冰醋酸 | 小苏打 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
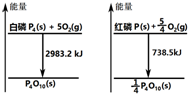
| A. | 白磷比红磷稳定 | |
| B. | 白磷燃烧产物比红磷燃烧产物稳定 | |
| C. | 1mol白磷转变为红磷放出2244.7kJ的热量 | |
| D. | 红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+2954 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| HF | HClO | H2S | C6H5OH |
| Ki=3.53×l0-4 | Ki=2.95×l0-8 | K1=9.1×l0-8 K2=1.1×l0-12 | Ki=1.28×l0-10 |
| A. | ClO-+H2S→HClO+HS- | B. | H2S+2C6H5O-→2C6H5OH+S2- | ||
| C. | HF+C6H5O-→C6H5OH+F- | D. | HF(少量)+S2-→F-+HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征为均匀稳定 | |
| B. | 胶体和溶液可以通过丁达尔效应来鉴别 | |
| C. | 可以用饱和氯化铁溶液和氢氧化钠溶液混合来制取氢氧化铁胶体 | |
| D. | 可以用过滤的方法净化胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com