
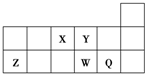
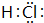 ,把它溶于水,由于共价键受到破坏而电离出H+和Q-,使溶液呈酸性.结构类型相同Y、W的氢化物的沸点从高到低排列次序是(填化学式)H2O>H2S.
,把它溶于水,由于共价键受到破坏而电离出H+和Q-,使溶液呈酸性.结构类型相同Y、W的氢化物的沸点从高到低排列次序是(填化学式)H2O>H2S.分析 由短周期元素X、Y、Z、W、Q在元素周期表中的相对位置,可知X为氮、Y为氧、Z为Al、W为硫、Q为Cl.
(1)X为氮元素,处于第二周期VA族,固态氮气属于分子晶体;
(2)W呈现最高化合价的化合物为三氧化硫;
(3)氧化铝是两性氧化物,与氢氧化钠反应生成偏铝酸钠与水;
(4)Q的氢化物为HCl,把它溶于水,共价键受到破坏而电离出H+和Cl-,使溶液呈酸性;
水分子之间存在氢键,沸点高于硫化氢;
(5)上述元素的最高价氧化物对应的水化物酸性最强的是高氯酸;
(6)Y、Q的单质或两元素之间形成的化合物可作水消毒剂的有臭氧、氯气、ClO2等.
解答 解:由短周期元素X、Y、Z、W、Q在元素周期表中的相对位置,可知X为氮、Y为氧、Z为Al、W为硫、Q为Cl.
(1)X为N元素,处于第二周期VA族,固态氮气属于分子晶体,
故答案为:N;二、VA;分子;
(2)S和O形成的化合物中,S呈现呈现最高化合价的化合物为SO3,
故答案为:SO3;
(3)Al2O3是两性氧化物,与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:两;Al2O3+2NaOH=2NaAlO2+H2O;
(4)Q的氢化物为HCl,电子式为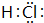 ,把它溶于水,共价键受到破坏而电离出H+和Cl-,使溶液呈酸性;水分子之间存在氢键,沸点高于硫化氢,
,把它溶于水,共价键受到破坏而电离出H+和Cl-,使溶液呈酸性;水分子之间存在氢键,沸点高于硫化氢,
故答案为: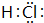 ;共价键;酸;H2O>H2S;
;共价键;酸;H2O>H2S;
(5)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4,
故答案为:HClO4;
(6)Y、Q的单质或两元素之间形成的化合物可作水消毒剂的有O3,Cl2,ClO2等,
故答案为:O3,Cl2.
点评 本题考查元素周期表与元素周期律,比较基础,有利于基础知识的巩固,熟记原子结构、物质结构和元素周期律知识.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
. ,EB4
,EB4 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯离子的结构示意图: | |
| B. | CCl4的电子式: | |
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| D. | 用电子式表示氯化氢分子的形成过程:H+ → → |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
, .两种离子中,半径较小的是Na+(填离子符号).
.两种离子中,半径较小的是Na+(填离子符号). B2C2
B2C2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子核外电子层数随核电荷数的增多而增多 | |
| B. | 单质的颜色随核电荷数的增多而加深 | |
| C. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增多而增大 | |
| D. | 它们的氢化物的稳定性随核电荷数的增多而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CHF=CHCl存在顺反异构 | |
| B. | 结构不同,性质相同,化学式相同的物质互称同分异构体 | |
| C. |  和 和 均是芳香烃, 均是芳香烃,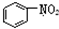 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| D. |  和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.5mol•L-1•s-1 | B. | vB=0.3 mol•L-1•s-1 | ||
| C. | vC=0.8 mol•L-1•s-1 | D. | vD=1.0 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol/(L•s) | B. | 0.4 mol/(L•s) | C. | 0.6 mol/(L•s) | D. | 0.8 mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com