
| A. | V=0时:[H+]>[Cl-]=[CH3COOH] | B. | V=10 mL时:[OH-]+[CH3COO-]=[H+] | ||
| C. | V=20 mL时:[Na+]=[CH3COO-]+[Cl-] | D. | 加入NaOH溶液至pH=7时,V>20 mL |
分析 A.未加NaOH时,浓度均为0.1mol.L-1的HC1和CH3COOH混合溶液中,盐酸完全电离,醋酸部分电离;
B.加入l0mLNaOH时,盐酸全部反应,为等浓度氯化钠、醋酸混合溶液,结合溶液中的质子守恒;
C.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠混合物,溶液呈碱性,结合电荷守恒判断;
D.加入20mLNaOH时溶液呈碱性,要使溶液pH=7,应有过量的醋酸.
解答 解:A.未加NaOH时,浓度均为0.1mol.L-1的HC1和CH3COOH混合溶液中,盐酸完全电离,醋酸部分电离,c(H+)>c(Cl-)>c(CH3COOH),故A错误;
B.加入l0mLNaOH时,盐酸全部反应,为等浓度氯化钠、醋酸混合溶液,溶液中存在质子守恒c(OH-)+c(CH3COO-)=c(H+),故B正确;
C.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠混合物,根据电荷守恒:c(Cl-)+c(OH-)+c(CH3COO-)=c(H+)+c(Na+),溶液显示碱性,c(OH-)>c(H+),故c(Na+)>c(Cl-)+c(CH3COO-),故D错误.
D.加入20mLNaOH时溶液呈碱性,要使溶液pH=7,应有过量的醋酸,则氢氧化钠溶液体积小于20mL,故D错误.
故选:B.
点评 本题考查离子浓度大小比较、弱电解质电量、酸碱混合的酸碱性定性判断等,题目难度中等,理解电荷守恒、物料守恒、质子恒等式在离子浓度大小比较中应用.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠跟冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 2.7 | 250mL | 天平、烧杯、玻璃棒、胶头滴管、药匙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
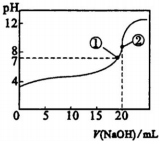
| A. | 滴加至①时,c(Na+)=c(CH3COO-),酸碱恰好完全反应 | |
| B. | 滴加至②时,c(OH-)-c(H+)=c(CH3COOH) | |
| C. | 滴定中,$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$逐渐减小 | |
| D. | 滴定中.c(CH3COOH)与c(CH3 C00-)之和保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com